研究背景
胎生是脊椎動物中廣泛存在的一種生殖策略,其特征為受精卵在母體內發育,直至胚胎發育成熟后才被產出。與這一普遍模式形成鮮明對比的是,海馬科物種演化出了極為特殊的“雄性懷孕”現象,該獨特的生命史策略為研究動物生殖系統的演化提供了重要窗口:功能性相似的生殖方式究竟源于趨同的分子機制,抑或是通過同源通路或全新的細胞調控路徑實現?盡管已有比較基因組學研究初步揭示了該生殖方式轉變的遺傳背景,然而相關基因在特定細胞類型中的表達模式及其演化軌跡仍不清楚。
在結構上,海馬育兒袋與有袋類動物的育兒袋具有一定相似性,并在功能上融合了羊膜動物子宮與胎盤的特點。在雄性懷孕過程中,其育兒袋內層組織發生顯著肥大與血管化,形成一種被稱為“偽胎盤”的結構,可執行氣體交換與營養物質傳遞等典型的胎盤功能。此外,海馬在進化過程中丟失了?foxp3?基因——該基因在哺乳動物中對調節性T細胞(Treg)的發育與功能維持具有核心作用,這一遺傳缺失也引發了對其在懷孕過程中免疫耐受機制的特殊適應性的探討。
研究內容和結果
對海馬育兒袋7個發育階段進行單細胞轉錄組測序,鑒定出14個細胞簇,分為四大主要細胞類型:上皮細胞(EPCs,9個簇)、成纖維細胞(FBs,2個簇)、免疫細胞(ICs,2個簇)和內皮細胞(ENCs,1個簇)。細胞的空間分布對細胞間相互作用及其功能維持至關重要。
對妊娠早期胎盤囊進行空間轉錄組測序(測序平臺BMKMANU?S1000)發現,EPCs在胎盤囊的三層結構中均呈現高豐度。其中,EPCs-II(高表達C型凝集素)在外層富集,可能暗示其在早期聚集外部吸附物或抑制表皮細菌方面發揮作用。相比之下,EPCs-III(tfa+)和EPCs-IV(gata1+)在內層富集,與“鐵穩態”、“細胞遷移”及“血管發育”相關,其在雄性妊娠胎盤形成過程中可能參與侵襲和血管化過程。作為細胞外基質(ECM)的主要來源,FBs存在于中間層,富集“膠原蛋白生成”,可能促進胎盤囊結構形成和組織重塑。ICs則分散于三層結構中,調控免疫穩態。
基于scRNA-seq,scATAC-seq,空間轉錄組數據聯合分析,作者發現了具有干細胞潛能的”育兒袋上皮祖細胞(BEPCs)”。研究顯示,該類細胞在發育過程中與膠原蛋白基因呈現協同表達,并受到雄激素信號的強烈驅動。研究進一步證實,外源性雄激素處理可誘導雌性海馬形成育兒袋結構。由此,雄激素受體及其調控的育兒袋上皮祖細胞作為觸發育兒袋器官生成的關鍵起始因子。
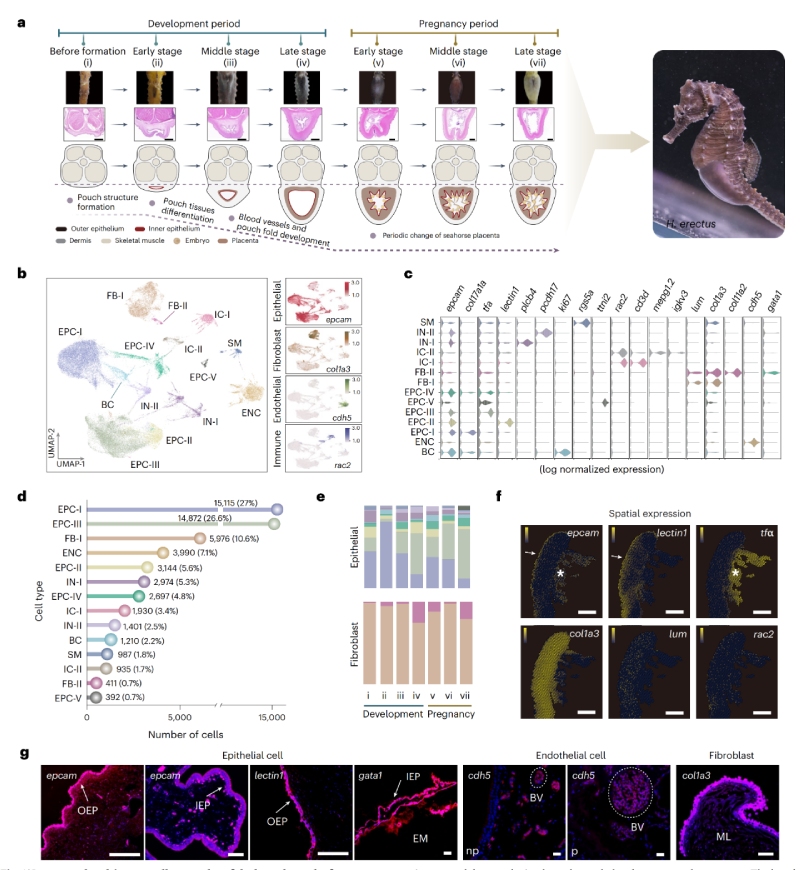
圖1?細胞圖譜構建
在雄性妊娠期間,海馬卵囊內層會發生顯著的形態學改變并呈現肥大,形成類似胎盤的組織結構,在細胞譜系轉變過程中,多個海馬特異性基因(如pastn1、sp-chia)在偽胎盤形成中起關鍵作用。作者發現EPC-I(muc15)、EPC-I(cxcl14)和EPC-IV在人類中與絨毛外滋養層細胞(EVTs)及絨毛滋養層細胞(VCTs)具有高度相似的基因表達譜,海馬雄性妊娠和哺乳動物常規雌性妊娠的胎盤形成過程,可能具有趨同的細胞機制和調控基礎。海馬缺乏foxp3基因(哺乳動物中調控Treg細胞的關鍵基因),但可能通過其它免疫細胞(如cd4+il2rb+?Tregs?和巨噬細胞)維持對胚胎的免疫耐受。
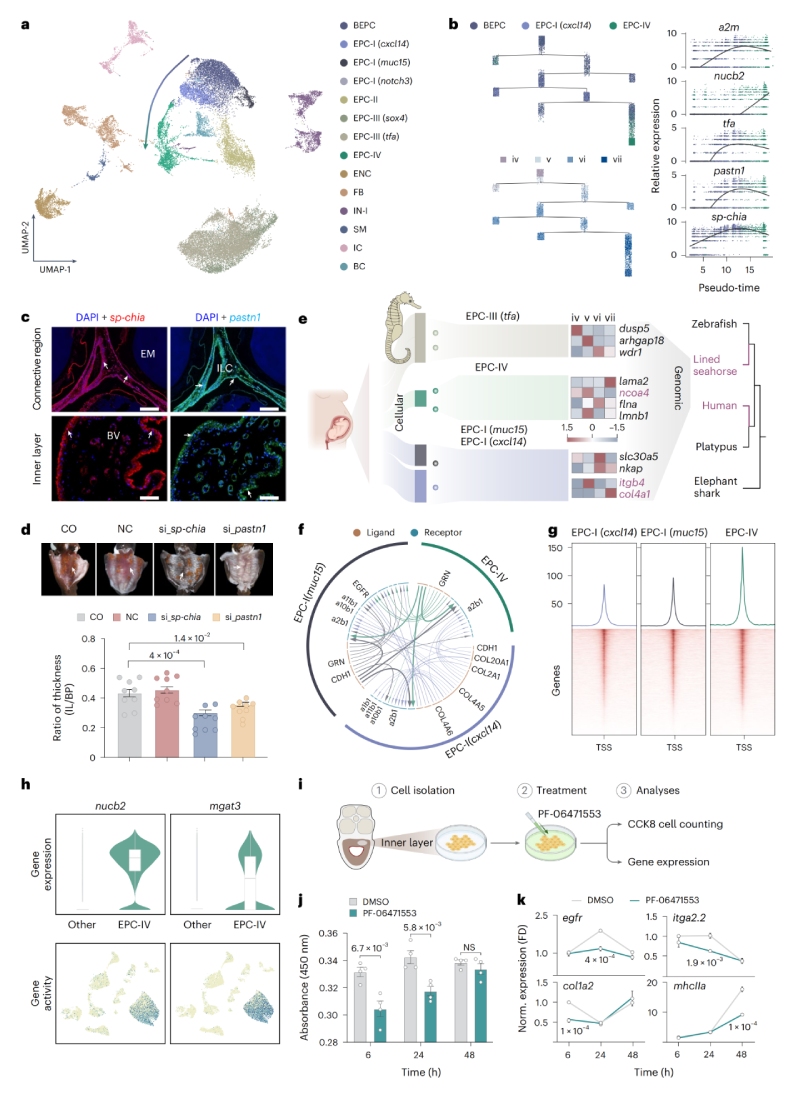
圖2?海馬假胎盤形成與子宮重塑的單細胞轉錄組分析圖譜
通過跨物種比較基因組學與單細胞多組學分析發現,盡管存在物種特異性差異,海馬假胎盤中的多數細胞類型在轉錄組特征上高度近似于人類的滋養層細胞——后者在調控胎兒生長及母體妊娠適應中發揮關鍵作用。其中,EPCs-II型細胞兼具表皮分化特征與凝集素介導的黏附功能,其可能是卵囊演化起源的重要線索。
進一步研究表明,海馬育兒袋與哺乳動物子宮在細胞和遺傳層面具有顯著同源性。海馬與哺乳動物生殖系統所呈現的趨同進化現象,可能源于特定細胞類型通過趨同演化形成相似的轉錄特征,進而實現類似功能,最終推動胎生機制的形成。
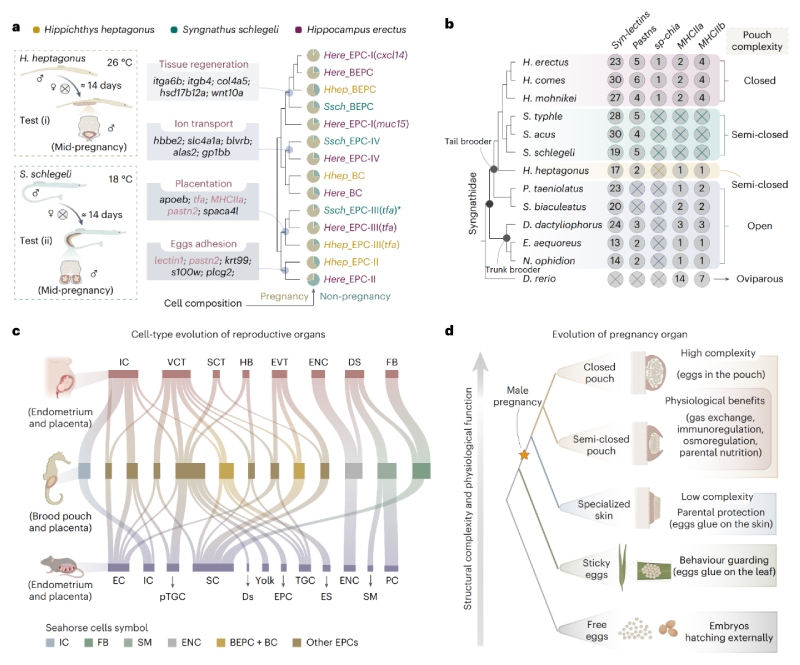
圖3?細胞類型進化分析
研究總結
該研究通過細胞分子與發育生物學的多維度分析,深入解析其卵囊發育與妊娠過程中的細胞遺傳動態。研究發現,卵囊形成的關鍵在于一種具有干細胞潛能的“育兒袋上皮祖細胞”群體。體內實驗證實,雄激素在卵囊形成中起主導作用。通過對其它動物的對比研究,作者揭示了海馬雄性親代撫育的早期進化機制,以及其細胞特征,存在與哺乳動物胎生動物相似的生命功能的趨同演化。
]]>研究背景
慢性肉芽腫病(Chronic?Granulomatous?Disease,?CGD)是一種由NADPH氧化酶2(NOX2)復合體功能缺失突變引起的原發性免疫缺陷病。這種缺陷會導致產生ROS的多種先天免疫細胞受到損害,機體抵御微生物的能力下降,導致CGD患者易發生反復感染和過度炎癥反應。本研究通過構建自然CGD小鼠模型,結合單細胞轉錄組(scRNA-seq)和空間轉錄組技術(包括BMKMANU?S1000平臺),深入解析了CGD肺部肉芽腫形成的細胞與分子機制,從CGD肺肉芽腫組織中鑒定出具有NOS2高表達特征的中性粒細胞和MMP12+巨噬細胞,并提出MIF和Morbidity為CGD治療的潛在靶點。
研究內容及結果
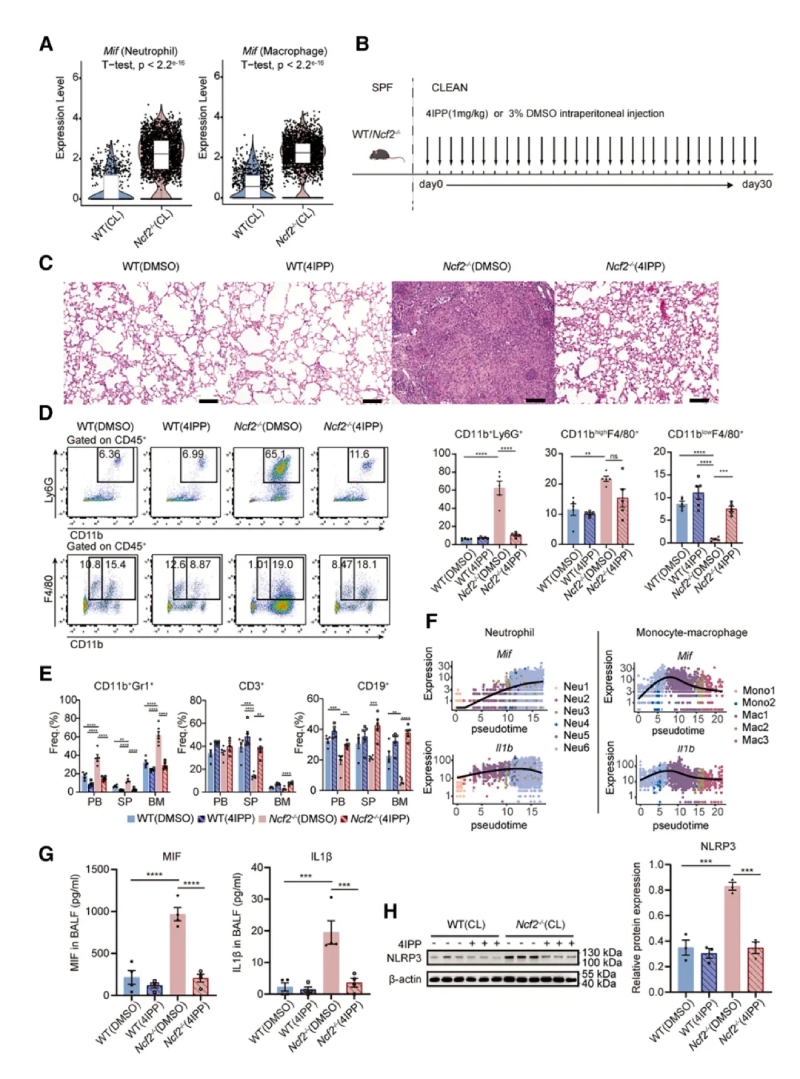
1、通過接觸清潔環境(CL)建立CGD肉芽腫模型
通過不同環境暴露(SPF或CL)實驗,系統研究了環境病原體對CGD遺傳背景小鼠表型的影響。表現為HE染色全肺葉顯微圖像可見CL環境下的Ncf2?/?小鼠肺部出現明顯的肉芽腫結構,伴隨炎癥細胞浸潤和組織壞死,其他組小鼠肺部正常。免疫熒光顯示肉芽腫中的巨噬細胞(CD68+)表達上皮標志物E-cadherin,提示巨噬細胞發生上皮樣轉化。通過ELISA法檢測CL?Ncf2?/?小鼠血清中的IL-1β和IFN-γ炎癥相關蛋白水平較CL?WT組增加。16S?rRNA/ITS?測序顯示CL?Ncf2?/?小鼠肺部細菌(如克雷伯菌和葡萄球菌)和真菌(如Talaromyces)負荷顯著增加。
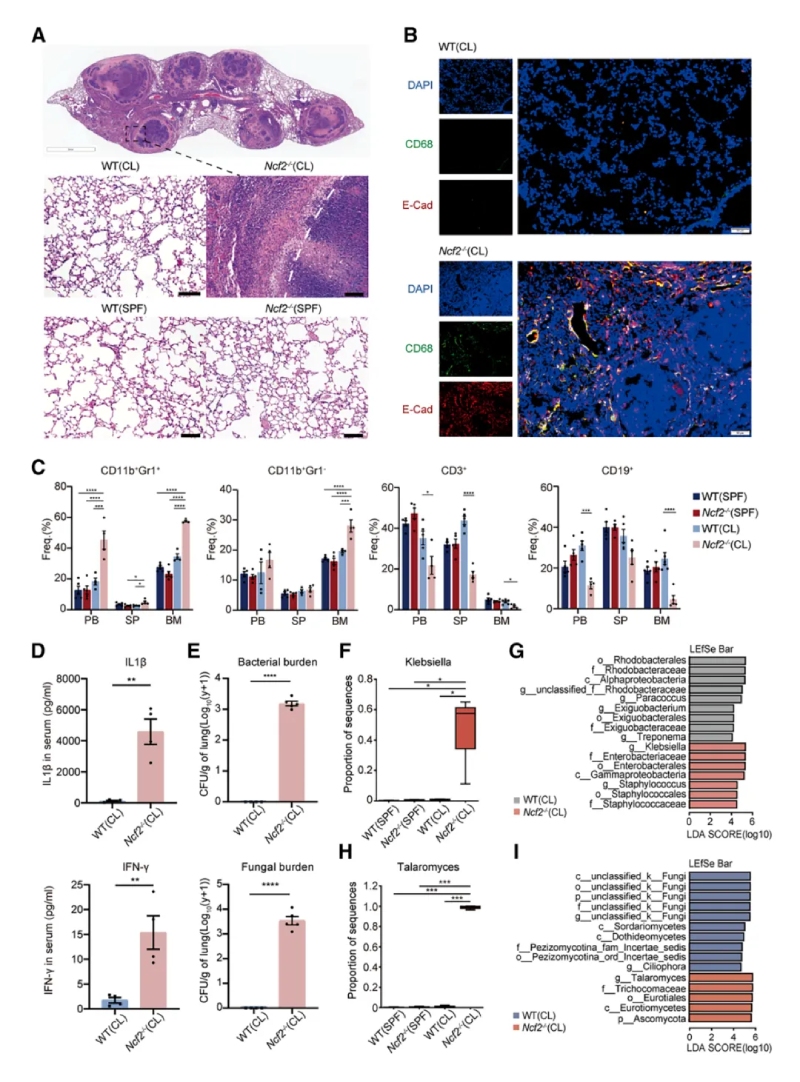
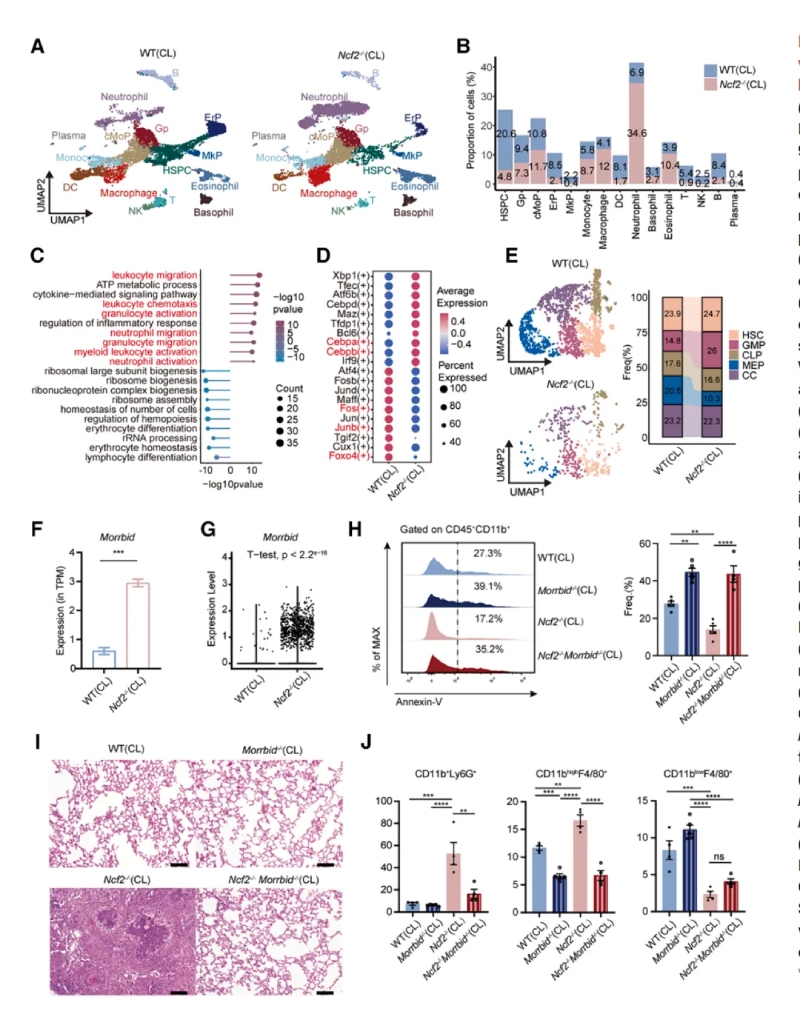
2、單細胞分辨率下小鼠肺部免疫景觀的分析
通過單細胞RNA測序和流式細胞術分析發現CGD小鼠肺部炎癥微環境以髓系細胞浸潤為主,提示其參與肉芽腫形成。其中單細胞測序,最終保留了25296個高質量細胞樣本,每個細胞平均包含6466條比對讀數和1972個基因,并識別出9種免疫細胞類型及九種基質細胞類型。還發現一個以細胞周期相關基因(Mki67和Top2a)高表達為特征的細胞簇。通過流式細胞術分析發現,CL?Ncf2?/?小鼠中CD11b高表達的F4/80+MDMs在比例和絕對數量上均顯著增加,這些結果揭示了慢性肉芽腫性葡萄膜炎(CGD)小鼠在肺部感染過程中免疫細胞組成的顯著變化,尤其是中性粒細胞和MDMs的明顯聚集現象。
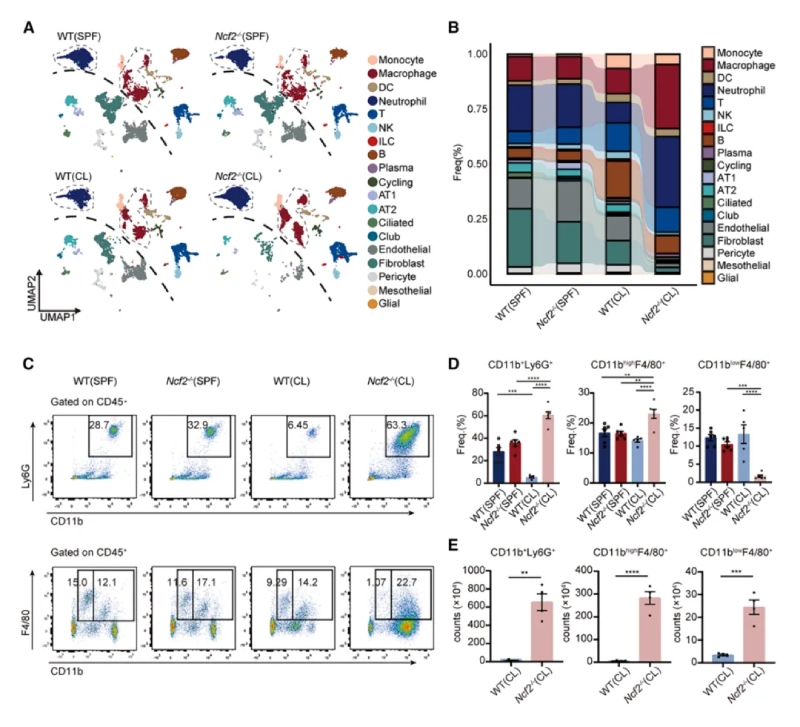 3、CGD小鼠中性粒細胞的轉錄改變
3、CGD小鼠中性粒細胞的轉錄改變
研究顯示,中性粒細胞分為6個亞群,其中Neu6亞群在CL?Ncf2?/?小鼠中顯著擴增且Neu6高表達促炎基因(如Nos2、Mif、Tnf、Il1b)。NO是一種在病原體清除過程中起關鍵作用由NOS2合成的可擴散小分子,CL?Ncf2?/?小鼠肺部的總NO生成量顯著升高。流式驗證顯示CL?Ncf2?/?小鼠肺中NOS2high中性粒細胞比例顯著增加。這些結果均提示NOS2high中性粒細胞通過產生一氧化氮(NO)和促炎因子,驅動肉芽腫核心區的炎癥反應。
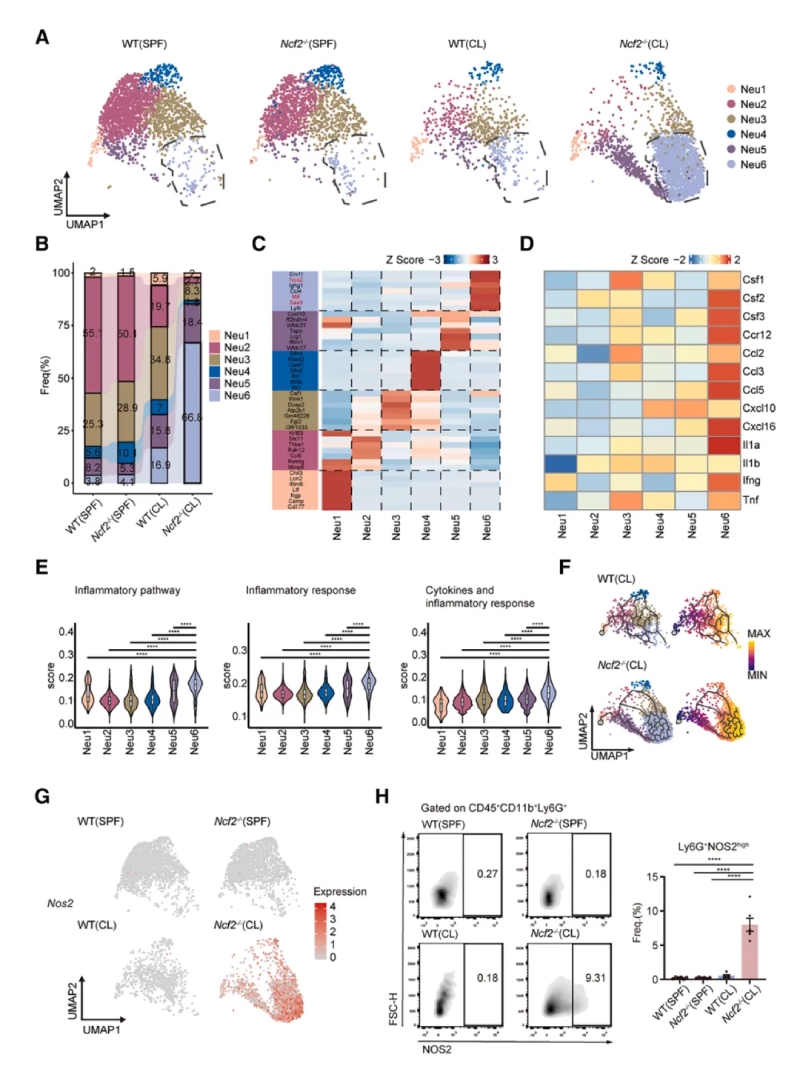 4、CGD小鼠單核細胞-巨噬細胞區室的轉錄改變
4、CGD小鼠單核細胞-巨噬細胞區室的轉錄改變
通過對巨噬細胞亞群進行聚類分析和功能富集,發現巨噬細胞分為5個亞群,Mac1亞群在CL?Ncf2?/?小鼠中顯著增加。Mac1同時表達M1(Nos2)和M2(Arg1)標志物,以及促纖維化基因(如Mmp12、Spp1)。免疫熒光顯示MMP12+巨噬細胞特異性分布于肉芽腫外圍。以上結果提示MMP12+巨噬細胞具有混合表型,可能通過細胞外基質重塑促進肉芽腫的纖維化包裹。
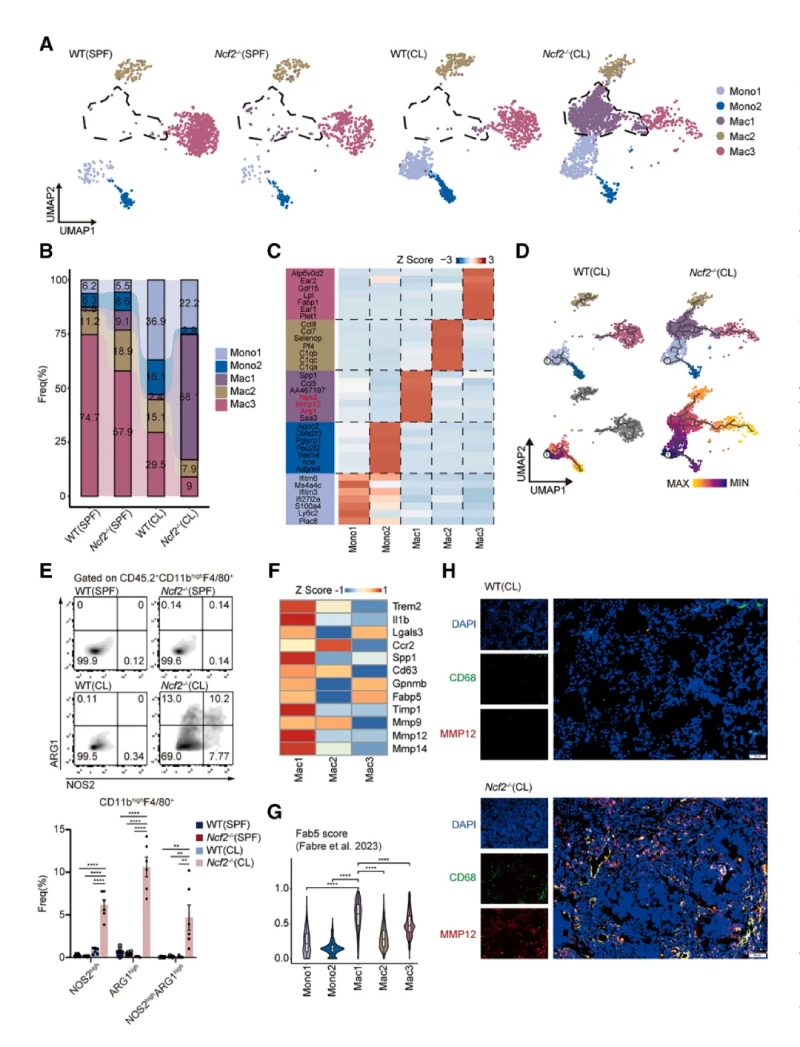 5、空間轉錄組揭示肉芽腫結構
5、空間轉錄組揭示肉芽腫結構
使用SeekSpace和BMKMANU?S1000平臺分析肺組織切片的空間轉錄組。研究表明肉芽腫核心區富集中性粒細胞(Neu6亞群),外圍富集巨噬細胞(Mac1亞群)和成纖維細胞。Mac1高表達促炎(Nos2)和促纖維化(Mmp12、Fn1)基因。成纖維細胞高表達膠原基因(Col1a1、Col4a1),提示其參與纖維化。
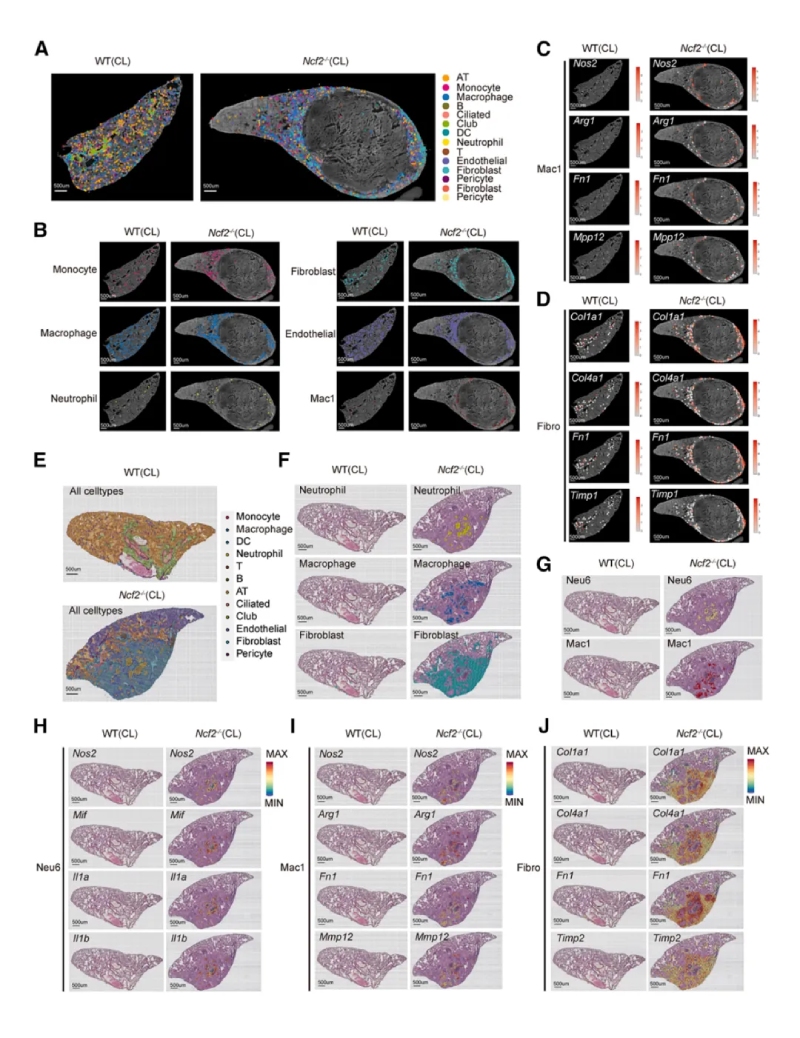
以上結果提示通過BMKMANU?S1000平臺進行的空間轉錄組發現Neu6占據肉芽腫中心區域,而Mac1和成纖維細胞在外圍區域參與細胞外基質重塑和纖維化包被過程。明確了肉芽腫中不同細胞的分布和功能分工,揭示了炎癥與纖維化的協同作用。
6、干預策略的效果驗證
通過對巨噬細胞亞群進行聚類分析和功能富集,發現巨噬細胞分為5個亞群,Mac1亞群在CL?Ncf2?/?小鼠中顯著增加。Mac1同時表達M1(Nos2)和M2(Arg1)標志物,以及促纖維化基因(如Mmp12、Spp1)。免疫熒光顯示MMP12+巨噬細胞特異性分布于肉芽腫外圍。以上結果提示MMP12+巨噬細胞具有混合表型,可能通過細胞外基質重塑促進肉芽腫的纖維化包裹。
 研究總結
研究總結
首次通過環境暴露構建自然CGD模型,結合多組學技術解析肉芽腫的細胞和分子機制。本研究揭示了CGD肉芽腫中NOS2high中性粒細胞和MMP12+巨噬細胞的協同作用,并提出MIF和Morrbid作為潛在治療靶點,為CGD的精準干預提供了理論基礎。BMKMANU?S1000空間轉錄組通過高分辨率空間定位明確揭示了中性粒細胞(Neu6亞群)在肉芽腫核心、巨噬細胞(Mac1亞群)和成纖維細胞在外圍的分布。在基因表達驗證時確認了NOS2、MIF、IL-1β等基因在肉芽腫不同區域的差異表達,這一結果與scRNA-seq結果高度一致,展示了BMKMANU?S1000在疾病微環境研究中的高效性。
]]>中文題目:5-ASA的腸道微生物代謝降低了其在炎癥性腸病中的臨床療效
發表期刊:nature medicine
發表時間:2023
影響因子:82.9
研究背景
炎性腸病 (IBD)是一種慢性、使人虛弱的胃腸疾病,治療失敗率較高。目前尚無系統的方法預測對IBD療法的反應。抗炎藥物美沙拉嗪,也被稱為5-氨基水楊酸 (5-ASA),是IBD最常用的處方療法之一,通常在結腸內發揮作用;然而,隨著時間的推移,超過一半的IBD患者對5-ASA沒有反應或最終失去反應。因此,有必要確定并消除此類治療失敗的原因。
研究思路
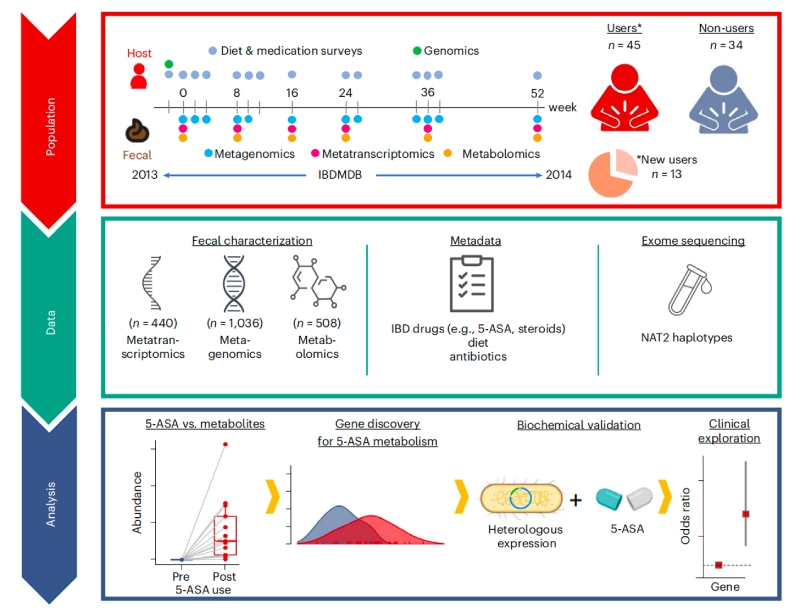
研究重點
1、來自IBD患者的多組學研究確定了5-ASA的使用
利用人類微生物組項目炎癥性腸病多組學數據庫(IBDMDB,http://ibdmdb.org),對79名克羅恩病(CD)或潰瘍性結腸炎(UC)患者的糞便樣本進行多組學分析,共鑒定了1036個宏基因組(MGX)、440個元轉錄本(MTX)和508個非靶向代謝組(MBX),以及283個MBX-MGX對和213個MGX-MTX對。隨后針對13名新使用5-ASA的患者來確定5-ASA在體內直接調節的特定糞便代謝物,結果發現5-ASA使用前后中的5-ASA和N-乙酰5-ASA水平呈顯著差異,且經5-ASA治療后,賴氨酸合成途徑中的細菌代謝產物—2-氨基己二酸的含量減少,煙酸代謝也發生了顯著變化。
進一步評估微生物、宿主和其他因素對這些差異顯著的代謝物的相對貢獻,最終發現5-ASA的藥物水平在確定5-ASA調節代謝物水平方面具有最大的預測能力(35%),其次是微生物組特征(15%)和其他宿主因素(7%)。隨后,通過另一個獨立的IBD患者隊列中鑒定并驗證了兩種可能的5-ASA衍生物—N-丙酰基5-ASA和N-丁酰基5-ASA,它們的變化可以部分地由腸道微生物組來解釋。
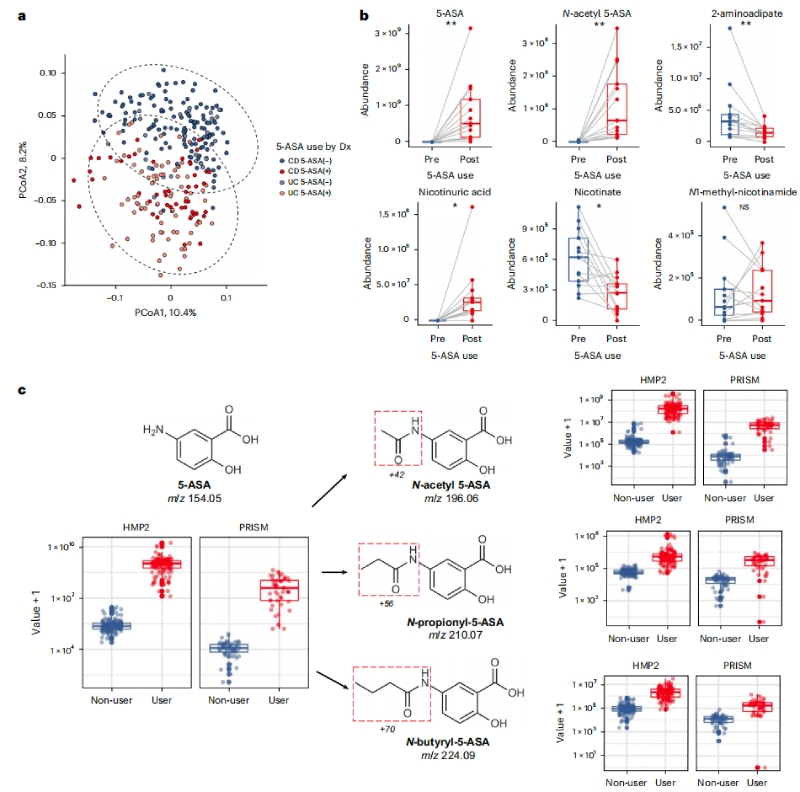
圖1?5-ASA可直接影響糞便代謝組,并通過微生物組進行生物轉化
2、5-ASA代謝腸道微生物酶的鑒定
接下來確定參與5-ASA生物轉化的腸道微生物酶。首先對服用及未服用5-ASA的患者微生物進行轉錄組分析,最終鑒定了兩個顯著過表達的具有推定乙酰轉移酶功能的UniRef90基因簇:GNAT家族NAT(UniRef90 ID: C7H1G6)和乙酰輔酶a乙酰轉移酶(UniRef90 ID: R6TIX3),以及四個具有乙酰輔酶a乙酰轉移酶結構域的候選基因(IDs: R6CZ24, R5CY66, T5S060和A0A1C6JPG6)。隨后將糞便樣本分為N-乙酰5-ASA高水平和N-乙酰5-ASA低/陰性水平兩組,計算與N-乙酰5-ASA相關的每個元轉錄組基因簇的敏感性和特異性,結果發現了另外7個假定的乙酰轉移酶基因簇與使用者的N-乙酰5-ASA水平呈正相關。最終得到的12個之前未被表征的候選乙酰轉移酶可分為硫解酶和酰基輔酶A N-酰基轉移酶兩組,其中酰基輔酶A NAT家族比硫解酶家族表現出更大的序列異質性,且酰基輔酶A NAT酶幾乎都來自擬桿菌門,而硫解酶來自厚壁菌門。通過研究菌株水平的基因組,同樣發現了一部分普氏鐮孢菌株編碼相關的乙酰轉移酶。

圖2N-乙酰5-ASA微生物酶包括硫代酶和酰基輔酶A N-乙酰轉移酶
3、5-ASA失活酶生化特性的推定
為了推測硫解酶和酰基輔酶A NAT超家族具有潛在的5-ASA滅活能力,選用來自厚壁菌門的候選硫解酶CAG:176(UniRef90 ID: R6CZ24)和來自福氏假單胞菌的酰基輔酶A NAT(UniRef90 ID:C7H1G6)用于進一步的生化表征。用已知的腸道鏈球菌酶作為陽性對照,對乙酰化5-ASA采用體外質譜分析,最終證實了厚壁菌CAG:176硫解酶和F. prausnitzii酰基輔酶A NAT具有使用乙酰輔酶A乙酰化5-ASA的能力。
隨后測試了硫解酶對其他含胺基異生素(包括5-ASA異構體4-ASA、異煙肼、普魯卡因胺和肼屈嗪)的乙酰化活性,結果并未發現這些化合物的任何乙酰化,這表明了硫解酶的底物選擇性。此外,編碼第二個預測的硫解酶基因(R6TIX3)的Oscillibacter sp菌株KLE 1745的活培養物也能夠將5-ASA乙酰化為N-乙酰基5-ASA。
為了深入了解厚壁菌CAG:176硫解酶(FcTHL)如何乙酰化5-ASA,將FcTHL的乙酰化未配體晶體結構疊加在乙酰化硫解酶晶體結構上,與來自充分表征的革蘭氏陰性分枝菌(ZrTHL)的乙酰輔酶A復合。隨后將FcTHL與NAT (PDB ID: 2PFR)的晶體結構進行比對,進一步探究厚壁菌CAG:176硫解酶的推定活性位點是否類似于腸道鏈球菌NAT的活性位點,最終揭示了活性位點區域中的半胱氨酸和組氨酸三聯體。
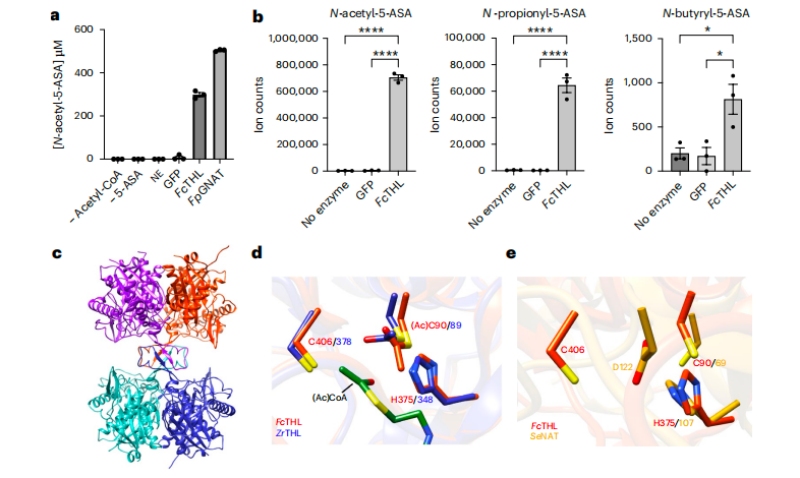
圖3?5-ASA在體外的乙酰化活性的證實
4、IBD治療失敗與5-ASA代謝酶的宏基因組攜帶有關
基于臨床服用5-ASA的個體差異性,接下來檢查12種乙酰轉移酶的存在是否與5-ASA治療失敗有關。收集39名在任何時間點接受5-ASA治療及使用類固醇患者的609份糞便樣本,使用多變量邏輯回歸模型,調整與疾病風險相關了因素-年齡、性別、吸煙狀況和IBD亞型,納入每個參與者的NAT2表型來解釋宿主遺傳,最終發現糞便樣本中存在4種乙酰轉移酶基因與類固醇起始風險增加顯著相關。4種乙酰轉移酶基因有三種來自硫解酶超家族,一種來自酰基輔酶A超家族。且較早的發病年齡和CD與UC狀態相比,同樣與開始使用類固醇的更高風險顯著相關。但未發現類固醇使用風險和大腸桿菌NAT的宏基因組存在聯系。
在敏感性分析中,微生物乙酰轉移酶基因數量的增加與類固醇起始風險的增加顯著相關;從未使用過5-ASA治療的患者基因家族與類固醇的使用沒有正相關。隨后使用混合效應模型對參與者進行調整,發現存在三個或更多乙酰轉移酶基因也與類固醇使用風險增加相關,這在隨后在未使用類固醇的208名5-ASA使用者隊列中得到了驗證。
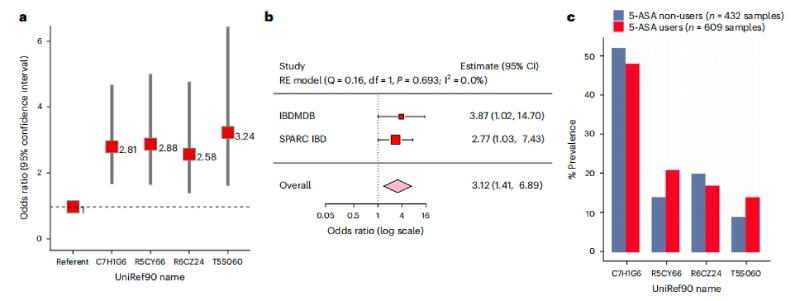
圖4腸道微生物5-ASA滅活乙酰轉移酶與5-ASA使用者治療失敗的更大風險相關
研究總結
本研究結果首次提供了特異性腸道代謝酶與IBD 5-ASA治療失敗之間的直接聯系,從而產生了直接的臨床潛力。5-ASA是UC最常用的處方藥。為了保持有效,它必須以未修飾的形式存在于結腸腔中,因此,與其他藥物不同,它在小腸中的吸收很差。5-ASA治療失敗的個體通常進展為風險更高的免疫抑制治療,而只有在必要時 (即腸道微生物組中存在修飾5-ASA的硫解酶序列)才有能力這樣做,這將為精準醫學提供有價值的生物標志物。此外,闡明微生物失活5-ASA的酶學機制可能有助于未來研發微生物特異性酶抑制劑,以增強5-ASA的療效。在本研究中,我們的數據是觀察性的;需要更多的介入研究來加強我們的發現,無論是通過在IBD患者中的臨床試驗還是通過單定植小鼠。目前,這些發現為IBD的個性化微生物醫學打開了一扇概念之窗。
]]>1、前言
1.1適用范圍
本指南介紹百邁客動物類組織&核酸樣品的送樣要求及制備方法。采集送樣前請詳細閱讀。信息單中樣本名稱、組織部位必須與實物相符,避免因信息單與實物不符導致反復核對,影響樣本質量、錄入周期,導致提取核酸質量不滿足建庫測序要求,實驗周期過長等
1.2提取風險提示
核酸提取質量與物種及組織部位、樣本制備、樣本交接、提取方法與操作、以及環境等因素息息相關,尤其是三代超長提取對樣的要求更高。組織提取時可能受到上下游處理操作的影響,因此較難保證單次提取滿足質量要求,望老師知悉理解,并做好組織備份。為保障獲得相對較高質量的核酸,請老師務必按照以下指導原則準備樣本。對于珍貴樣本或微量樣本,建議自行提取
2、組織送樣量要求
注1:未在表格出現的物種,請單獨溝通。送樣量結果展示為滿足提取一次的量,如樣品經過特殊處理或樣本狀態異常有幾率影響得率,為了保證您的實驗可以順利進行,請酌情增加送樣量
注2:由于骨骼含有大量鈣鹽和礦物質,細胞密度低,核酸含量較少;毛發暴露在外界環境,容易受到紫外線、溫度變化、微生物影響,導致核酸降解,毛干核酸含量低,毛囊周圍細胞多難獲取,為了保證您實驗的順利進行,這兩個部位不建議送組織樣,建議自行提取
| 物種 | 核酸類型 | 產品類型 | 組織部位(g/ml/個) | |||||||||
| 心臟 | 肝臟 | 脾臟 | 腎臟 | 腦 | 肌肉 | 腸道 | EDTA抗凝血液 | PAXgene管送樣血液 | 細胞 | |||
| 人 | DNA | 重測序 | 0.2 | 0.1 | 0.1 | 0.2 | – | 0.2 | 0.2 | 0.3 | – | 1*10e6 |
| 外顯子 | 0.2 | 0.1 | 0.1 | 0.2 | – | 0.2 | 0.2 | 0.3 | – | 1*10e6 | ||
| 甲基化 | 0.2 | 0.1 | 0.1 | 0.2 | – | 0.2 | 0.2 | 0.3 | – | 1*10e6 | ||
| ONT動植物重測序 | 0.5 | 0.25 | 0.25 | 0.5 | – | 0.2 | 0.2 | 0.5 | – | 5*10e6 | ||
| ONT動植物基因組 | 0.5 | 0.25 | 0.25 | 0.5 | – | 0.2 | 0.2 | 0.5 | – | 5*10e6 | ||
| PB動植物基因組 | 1 | 0.5 | 0.5 | 1 | – | 0.5 | 0.5 | 1 | – | 5*10e6 | ||
| RNA | 全長轉錄組(PB) | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.5 | 10 | 5*10r6 | |
| 全長轉錄組(ONT) | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.5 | 10 | 5*10r6 | ||
| 二代轉錄組 | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.5 | 10 | 3*10r6 | ||
| 真核小RNA | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.5 | 10 | 3*10r6 | ||
| 長鏈非編碼RNA | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.5 | 10 | 3*10r6 | ||
| 鼠 | DNA | 重測序 | 0.2 | 0.1 | 0.1 | 0.2 | – | 0.2 | 0.2 | 0.3 | – | 1*10e6 |
| 外顯子 | 0.2 | 0.1 | 0.1 | 0.2 | – | 0.2 | 0.2 | 0.3 | – | 1*10e6 | ||
| 甲基化 | 0.2 | 0.1 | 0.1 | 0.2 | – | 0.2 | 0.2 | 0.3 | – | 1*10e6 | ||
| ONT動植物重測序 | 0.5 | 0.25 | 0.25 | 0.5 | – | 0.2 | 0.2 | 0.5 | – | 5*10e6 | ||
| ONT動植物基因組 | 0.5 | 0.25 | 0.25 | 0.5 | – | 0.2 | 0.2 | 0.5 | – | 5*10e6 | ||
| PB動植物基因組 | 1 | 0.5 | 0.5 | 1 | – | 0.5 | 0.5 | 1 | – | 5*10e6 | ||
| RNA | 全長轉錄組(PB) | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.5 | 10 | 5*10r6 | |
| 全長轉錄組(ONT) | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.5 | 10 | 5*10r6 | ||
| 二代轉錄組 | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.5 | 10 | 3*10r6 | ||
| 真核小RNA | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.5 | 10 | 3*10r6 | ||
| 長鏈非編碼RNA | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.5 | 10 | 3*10r6 | ||
| 物種 | 核酸類型 | 產品類型 | 送樣量(g) |
| 皮膚 | DNA | 重測序 | 0.5 |
| 外顯子 | 0.5 | ||
| 甲基化 | 0.5 | ||
| ONT動植物重測序 | 1 | ||
| ONT動植物基因組 | 1 | ||
| PB動植物基因組 | 2 | ||
| Ultra Long ONT | – | ||
| RNA | 全長轉錄組(PB) | 0.5 | |
| 全長轉錄組(ONT) | 0.5 | ||
| 二代轉錄組 | 0.3 | ||
| 真核小RNA | 0.3 | ||
| 長鏈非編碼RNA | 0.3 | ||
| 毛發 | DNA | 重測序 | 0.5 |
| 外顯子 | 0.5 | ||
| 甲基化 | 0.5 | ||
| ONT動植物重測序 | 1 | ||
| ONT動植物基因組 | 1 | ||
| PB動植物基因組 | 2 | ||
| Ultra Long ONT | – | ||
| RNA | 全長轉錄組(PB) | 0.5 | |
| 全長轉錄組(ONT) | 0.5 | ||
| 二代轉錄組 | 0.3 | ||
| 真核小RNA | 0.3 | ||
| 長鏈非編碼RNA | 0.3 | ||
| 骨骼 | DNA | 重測序 | 0.5 |
| 外顯子 | 0.5 | ||
| 甲基化 | 0.5 | ||
| ONT動植物重測序 | 1 | ||
| ONT動植物基因組 | 1 | ||
| PB動植物基因組 | 2 | ||
| Ultra Long ONT | – | ||
| RNA | 全長轉錄組(PB) | 0.5 | |
| 全長轉錄組(ONT) | 0.5 | ||
| 二代轉錄組 | 0.3 | ||
| 真核小RNA | 0.3 | ||
| 長鏈非編碼RNA | 0.3 |
3、核酸送樣要求
1)核酸送樣需要提供相關檢測結果,DNA類核酸可提供以下檢測手段中的一種或多種檢測結果: Qubit、 NanoDrop、 AGE,同時請采取適當的純化方法,以避免多糖、多酚、蛋白或者核酸酶對DNA樣品的污染,并詳細注明溶解DNA所使用的溶解液類型
2)如果您開展的實驗項目為miRNA的相關實驗,并且提供的是總RNA的樣本,請務必確認您采用的總RNA的提取方法保留了小RNA ( 包括miRNA),提取試劑盒型號備注送樣信息單中
3.1二代DNA送樣量要求
| 產品類型 | SLAF | 重測序 | 甲基化 | 外顯子 | FFPE | PCR產物 | PCR-free | chip-seq |
| 濃度ng/ul | 5 | 1 | 5 | 6 | 14 | 0.6 | 40 | 1 |
| 總量ug | 1.5 | 0.1 | 1 | 0.1 | 0.25 | 0.1 | 1 | 0.06 |
| 體積ul | 15 | 15 | 15 | 15 | 20 | 15 | 15 | 15 |
3.2三代DNA送樣量要求
| 產品類型 | ONT動植物重測序 | ONT動植物基因組 | PB動植物基因組 | 超長 |
| 濃度ng/ul | 40 | 100 | 50 | 50 |
| 總量ug | 4 | 10 | 15 | 15 |
| 體積ul | 15 | 15 | 15 | 50 |
3.3RNA類送樣量要求
1)針對核酸有雜質、污染、粘稠、顏色等情況,需要過柱純化后送樣或者酌情增加送樣量
2)核酸樣品建議使用1.5ml、2ml EP管裝載樣品,其他保存管容易破裂且不利于保存樣品和后續實驗的開展
3)為了防止樣品污染和混淆,禁止使用96孔板和深孔板裝載樣品
4)用乙醇沉淀的樣品由于運輸中會有少量乙醇揮發,建議將樣品管蓋用封口膜纏繞4-5圈
5)考慮到核酸可能存在含有雜質、顏色等物質導致會產生大量損失的風險,為保證樣本一次檢測合格并節約寶貴的重送樣時間,送樣建議量是高于公司判定標準的,請在核酸量足夠的前提下盡量按照送樣建議來送樣。
| 項目類型 | 初檢結果(濃度、體積、純度) | 樣品狀態 | ||
| 濃度(ng/ul) | 總量(ug) | 體積(ul) | ||
| 全長轉錄組(PB) | 100 | 1 | 15 | 正常 |
| 全長轉錄組(ONT) | 100 | 1 | 15 | 正常 |
| 二代轉錄組 | 20 | 1 | 15 | 正常 |
| 真核小RNA | 80 | 1 | 15 | 正常 |
| 長鏈非編碼RNA | 80 | 1 | 15 | 正常 |
4、樣品制備保存指南
4.1常規動物類樣本
送樣需要選擇新鮮采集的樣本,尤其是Ultra long ONT建庫,樣本的取材優先選擇核酸含量相對較高的組織,樣本制備優先級:血液>內臟>肌肉。活體取下新鮮組織(肌肉、肝臟或其他組織,避免用易于寄生微生物的表皮和腸道、可能有變異細胞的病變組織),立即剔除結締組織和脂肪組織等非研究所需的組織類型。對腫瘤組織的取材,應盡可能準確地判定腫瘤和正常組織,腫瘤組織應將周圍的正常組織切除干凈(正常組織也應將周圍的腫瘤組織切除干凈),腸道組織一定要把內容物清洗干凈
4.1.1液氮速凍組織操作流程(所有產品適用)
1)提前準備好冷凍組織的足量液氮,預裝樣品的凍存管,并在做好標記(盡量不使用漢字命名,命名字符控制在5個以內)
2)活體取下新鮮的組織
3)迅速用預冷的PBS溶液(RNase free)或0.9%生理鹽水將組織表面的殘留血液沖洗干凈
4)如果組織體積較大,將組織切成長寬高均≤0.5 mm 的小塊(即黃豆大小)
5)將凍處理好的組織樣本混合均勻后保存于2 mL 或更大體積的螺口凍存管(RNase free)中,標注編號
6)立即(20s內)置于液氮中冷凍 3~4 h,然后轉移至-80 °C長期保存
7)干冰運輸
4.1.2TRIzol保存樣品制備流程(僅RNA細胞和研磨后的組織適用)
1)如果使用 TRIzol裂解液保存送樣,請務必先進行液氮研磨破碎,樣品量取參考標準送樣量的1/3,然后溶于 TRIzol 中,組織樣品切勿過量
2)震蕩混勻,常溫裂解 5 min 后,使用低溫離心機12000g離心10min,將上清液轉至新的2.0ml離心管中(拍質控照片,方便核查),轉移至-80℃低溫保存,運輸時選擇干冰寄送
3)禁止使用trizol保存組織樣品送樣

4.1.3RNAlater? Tissue Collection保存樣品制備流程(僅RNA適用)
1)用RNAlater? Solution保存組織之前,需要將組織切割成長寬高均≤ 0.5 mm的小塊
2)如果組織帶血液或其他體液,需要過夜后更換一次RNAlater? Solution;不要將剛浸入RNAlater Solution中的樣本立即冷凍,需將樣本置于4 °C 保存過夜(使Solution充分浸潤組織樣本),然后轉移至-20 °C 或-80 °C 長期保存
3)RNAlater? Solution 不會影響組織結構,可以把已保存的組織從 RNAlater? Solution中取出,切下實驗所需的用量,把剩余的組織再放入到原來的保存液中繼續保存
4)保存于RNAlater? Solution中樣本,-20 °C 存放時,樣本不會結凍,但可能會有晶體析出,這并不影響后續的 RNA 提取工作;-80 °C 存放時,樣本會結凍, 在進行 RNA 提取前,需置于冰上融化再進行后續操作,解凍后的樣本可再次放入-80 °C 保存
5)一般來講,生物樣本保存于RNAlater? Solution中,37 °C可存放1天,25 °C(室溫)可存放1周,4 °C 可存放1個月,-20 °C 或-80 °C 可長期保存。但鑒于生物樣本的特殊性及實驗可重復性,建議所有保存于RNAlater? Solution中樣本,都要置于-20 °C 或-80 °C 長期保存
注:如果組織較小,建議優先選擇此方式送樣
4.2全血
DNA類產品推薦使用EDTA抗凝管采集后分裝,RNA類產品優先推薦使用PAXgene血液RNA管采集。血樣建議為新鮮采集,不建議保存時間過長。血液相關產品僅接收全血或分離的細胞樣本,不接收血清、血漿。
4.2.1DNA常規產品制備操作流程
1)用醫用抗凝管或已裝有抗凝劑(選用檸檬酸鈉或 EDTA 抗凝劑,由于會影響實驗所以不可用肝素)的旋蓋管收集全血樣本
2)上下輕輕顛倒混勻十次后,分裝到常規EP管中(體積不要超過EP管的一半),轉移至-20或-80 °C長期保存(實際根據采血管的說明要求操作)
3)干冰運輸
注1:血液采集管請盡量不要用需專門對應提取試劑盒的采血管,以防送樣后我們因無對應試劑盒影響提取時間(盡量送樣前溝通)
注2:采集完血液之后需將血液轉移至EP管中,玻璃材質采血管冷凍之后易碎

4.2.2Ultra Long ONT樣本制備流程
4.2.2.1新鮮血液
1)采集血液( 5- 10mL),然后加入含 EDTA 抗凝管中(不可使用肝素 、檸檬酸鈉等抗凝管,建議使用 Cell-Free 采血管,做好標記(樣本名稱,日期,體積)
2)輕輕顛倒混勻十次,室溫正立放置
3)冰袋(4 °C )運輸需避開節假日(注意冰袋盡可能多放,樣本置于中間,保證箱體溫度維持在 4 °C)。從血液離體算起,運輸至實驗人員手中不可超過 3 天
4.2.2.2凍存血液
1)血液用抗凝管采集后輕輕顛倒混勻十次
2)哺乳動物血液分裝到 2ml 離心管里,1ml/管(至少2管,若血量不足,可根據實際情況送樣)
3)魚類、禽類、兩棲類全血分裝到 1.5ml 離心管里, 100ul/管(至少5管,若血量不足,可根據實際情況送樣)
4)做好標記(樣本名稱, 日期,體積),液氮速凍,干冰寄送
4.2.3RNA產品制備操作流程
4.2.3.1PAXgene血液RNA管制備流程(人和靈長類動物優先選擇該方式送樣)
1)PAXgene管的介紹
在研究細胞內 RNA 使用的許多分子測試中,采集全血是第一步。 這類測試中的最大挑戰是細胞內 RNA不穩定,在采血后幾小時內迅速降解。 此外,通過基因誘導過程,某些種類的 RNA 采血后在體外增加。 體外 RNA 降解和基因誘導均會導致體內基因轉錄物相對數量估計過低或過高。 PAXgene 血液RNA 管含有一種附加劑,通過減少體外 RNA 降解和盡量減少基因誘導,可穩定體內基因轉錄譜。 與PAXgene 血液 RNA 套件配套使用時,PAXgene 血液 RNA 管可以實現準確的基因轉錄物檢測和定量
2)采集前準備
A.PAXgene Blood RNA Tube(2.5mL采血管,含專用RNA穩定劑)
B.符合標準的靜脈采血裝置(無菌針頭、持針器、止血帶等)
C.毒用品(酒精棉片、碘伏等)
D.生物安全防護裝備(手套、護目鏡等)
3)采集流程
A.確保 PAXgene 血液 RNA 管使用前在 18-25?C 溫度下,且正確貼有標本識別標簽
B.如果 PAXgene 血液 RNA 管是待抽吸的唯一試管,應當先抽血至“丟棄管”,再抽血至 PAXgene 血液 RNA 管,這樣便可以灌注放血過程中使用的采血裝置的內部空間。 否則,PAXgene 血液 RNA 管應是放血程序中最后抽吸的試管
C.采用您所在機構推薦的標準靜脈穿刺技術程序,使用采血裝置和試管固定器,采血2.5ml至 PAXgene 血液RNA 管
D.采血后立即輕輕地將PAXgene 血液 RNA 管倒置 8–10 次
E.在室溫下 (18–25?C) 直立存儲 PAXgene 血液 RNA 管至少 2 小時,最多 72 小時,然后再處理或轉移至冷藏室 (2–8?C) 或冷凍室 (-20?C)。 若需要 -70?C / -80?C 的存儲溫度,請參見“PAXgene 血液RNA 管內所采集標本的冷凍和解凍程序” 以獲取詳細信息
4)注意事項
A.確保采血管在有效期內,無漏液或變色(正常試劑為淡黃色)
B.不可預先打開管蓋,避免穩定劑失效
C.一旦受到碰撞,冷凍的 PAXgene 血液 RNA 管就容易破裂。為降低在運輸期間破裂的風險,請按照處理玻璃管的方式來處理冷凍的試管。使用者必須確認自己的 PAXgene 血液 RNA 管冷凍和運輸協議
D.PAXgene 血液 RNA 管填充不足會導致血液與附加劑的比率錯誤,且可能導致分析結果錯誤或產品性能欠佳
E.PAXgene血液 RNA 系統不適用于采集和純化病毒 RNA
4.2.3.2EDTA抗凝管送樣制備流程
1)用醫用抗凝管或已裝有抗凝劑(選用檸檬酸鈉或 EDTA 抗凝劑,由于會影響實驗所以不可用肝素)的旋蓋管收集全血樣本
2)上下輕輕顛倒混勻十次后,分裝到常規EP管中(體積不要超過EP管的一半),轉移至-20或-80 °C長期保存(實際根據采血管的說明要求操作)
3)干冰運輸
4.3細胞
4.3.1貼壁細胞
4.3.1.1液氮速凍法
1)確定細胞生長狀態良好;離心得到細胞沉淀(依據客戶實驗室細胞離心步驟,注意細胞離心要適度,不要使細胞離心過實而造成裂解液不能充分滲透,4度離心機,轉速800g為宜)
2)棄去培養基,加入 1 mlLPBS(RNase free,室溫),輕輕將細胞沉淀懸起, 轉移至 2 mL 旋蓋尖底離心管(RNase free)中
3)離心(依據客戶實驗室細胞離心步驟,注意細胞離心要適度,不要使細胞離心過實而造成裂解液不能充分滲透,4度離心機,轉速800g為宜)得到細胞沉淀,棄去PBS,液氮速凍2h之后轉移至-80℃低溫保存,送樣時選擇干冰運輸寄送
4.3.1.2TRIzol裂解法
1)離心收集的細胞迅速溶于 TRIzol 裂解,每 5 X 10^6個細胞加 1 mL TRIzol
2)細胞溶于 TRIzol 后,如出現成團,需用吸頭將細胞團吹打散,或者激烈震蕩混勻,使細胞完全溶于 TRIzol 中充分裂解
3)室溫靜置5min,之后轉移至-80℃低溫保存,送樣時選擇干冰運輸寄送
注:判斷裂解液加入量是否合適的標準可以根據細胞溶解物的黏度來判斷。在細胞剛溶解時,可以發現有絲狀物出現,若裂解液加入量合適,吹打幾次后,絲狀物會消失,液體黏稠性下降;若裂解液的量過少,絲狀物往往一直存在,液體黏稠性大,應繼續補加裂解液。裂解液加入量過少,會導致抽提的 RNA 降解
4.3.2懸浮細胞
4.3.2.1液氮速凍法
1)確定細胞生長狀態良好;離心得到細胞沉淀(依據客戶實驗室細胞離心步驟,注意細胞離心要適度,不要使細胞離心過實而造成裂解液不能充分滲透,4度離心機,轉速800g為宜)
2)棄去培養基,加入 1 mlLPBS(RNase free,室溫),輕輕將細胞沉淀懸起, 轉移至 2 mL 旋蓋尖底離心管(RNase free)中
3)離心(依據客戶實驗室細胞離心步驟,注意細胞離心要適度,不要使細胞離心過實而造成裂解液不能充分滲透,4度離心機,轉速800g為宜)得到細胞沉淀,棄去PBS,液氮速凍2h之后轉移至-80℃低溫保存,送樣時選擇干冰運輸寄送
4.3.2.2TRIzol裂解法
1)離心收集的細胞迅速溶于 TRIzol 裂解,每 5 X 10^6個細胞加 1 mL TRIzol
2)細胞溶于 TRIzol 后,如出現成團,需用吸頭將細胞團吹打散,或者激烈震蕩混勻,使細胞完全溶于 TRIzol 中充分裂解
3)室溫靜置5min,之后轉移至-80℃低溫保存,送樣時選擇干冰運輸寄送
5、注意事項
核酸提取質量與物種及組織部位、采集方法及保存狀態、提取方法及操作、實驗器材及環境等因素均有密不可分的聯系,尤其是三代超長提取對樣本的質量、總量要求更高,望知悉及理解,并做好樣本備份。為了保障獲得高質量的核酸,請務必按照送樣手冊所規定的準備樣本。對珍貴樣本或者微量樣本,建議自行提取
1)組織速凍時間:組織離體后,胞內核酸便開始降解,尤其是 RNA,故采集時,目的組織離體后,需立即速凍,建議 3min 內完成,越快越好。速凍時間過短會導致速凍不徹底,核酸有降解風險
2)組織送樣量:建議送樣量適用于 95%的物種組織,少部分組織因胞內核酸量較低,需適當增加送樣量,比如動物皮膚、毛發等。請嚴格按照上方組織送樣量要求送樣,送樣量過少或過多均不利于提取實驗。采樣量較少會導致提取的核酸總量、濃度不合格,采樣量過多反而會造成速凍不徹底、提取取樣困難、凍融降解等危險
3)組織狀態:不建議送組織狀態差或非生長旺盛期樣品,核酸有一定幾率降解
4)組織保存管的選擇:所有組織樣品務必使用離心管或螺紋管保存,切勿直接裝入密封袋(低溫凍脆易破裂,導致樣品泄露,交叉污染)保存
5)組織樣品保存方法選擇:首選液氮速凍;沒有液氮條件的,可直接放入-80℃冰箱凍存。未使用液氮速凍或液氮速凍時間過短都有一定幾率導致核酸降解
6)組織送樣方式的選擇:干冰運輸,且需要保證干冰的充足,冰袋和常溫送樣,有幾率導致核酸的降解。除RNA類樣品可使用RNAlater保存送樣,其余產品均建議送速凍組織,不建議使用保護液送樣,化開離心會有幾率導致核酸降解;不建議酒精送樣,固定不徹底,有一定幾率殘留核酸酶,降解核酸
7)凍融組織: 組織凍存后,一旦凍融,核酸降解概率大于 80%,幾乎不可能提取成功,此類組織不建議送樣。請各位老師送樣前注意組織保存狀態, 確保組織未發生過凍融情況
8)帶血組織:由于血液沒有專業的保護劑,去除不凈一起速凍送樣會影響組織的完整性
9)長年保存的組織:保存時間超過一年的組織不建議送樣
10)組織分離要求:正常組織樣本中不能含有病變組織,而病變組織樣本中也不可以夾帶有正常組織,提取實驗時無法精確取樣,無法稱重。組織量過多的不能全部取樣,只隨機選取適量組織提取
11)對于同一個組織樣品需要同時提取 DNA和 RNA 的,請務必分成兩管分批次送樣。樣本的特殊處理包括:鹽處理、溫度處理、藥物處理、病毒侵染、傷害處理、干旱處理等脅迫處理方式,不同程度的處理對樣本的核酸質量會造成不同程度的影響,常見的會導致核酸 的降解或者得率降低。因此,經過特殊處理的樣本,在送樣時,務必請在樣本信息單中進行詳細的備注,以便盡量提高提取的成功率和避免樣本的浪費
6、不合格樣品存在風險
6.1樣本總量不足、濃度過低存在風險
1)文庫構建失敗
2)文庫產量低不能上機測序或測序數據量不足
3)導致數據隨機性異常
4)數據質量差
6.2降解樣本風險
1)文庫構建失敗
2)文庫產量低不能上機測序或測序數據量不足
3)導致數據隨機性異常
4)數據質量差
5)導致數據duplication比例高、隨機性差
6)導致Small RNA rRNA比例高,影響有效數據,文庫片段異常
6.3蛋白或其他雜質污染
1)可能影響Small RNA電泳分離,造成切膠不準,影響問題質量
2)可能影響RNA-seq磁珠分離導致建庫失敗,或即使達到上機要求也可能導致文庫隨機性差等問題
3)文庫構建失敗
4)文庫產量低不能上機測序或測序數據量不足
6.4目標RNA含量低
1)總RNA達到要求,但由于樣本特異性,small RNA含量低于正常樣本,導致建庫失敗
2)總RNA達到要求,但由于處理或組織部位的特異性,mRNA降解或含量低,導致建庫失敗或者測序數據中rRNA 數據比例高
]]>
文章標題:Spatial and single-cell transcriptomics reveal cellular heterogeneity and a novel cancer-promoting Treg cell subset in human clear-cell renal cell carcinoma
期刊名稱:Journal for ImmunoTherapy of Cancer
影響因子:10.3
合作單位:空軍軍醫大學(第四軍醫大學)
研究方法:單細胞轉錄組測序,空間轉錄組測序,流式分選,RT-qPCR,Western blot,免疫組化,多重免疫組化,細胞實驗。
百邁客生物為該研究提供了百創DG1000單細胞轉錄組測序服務以及百創S1000空間轉錄組技術服務,文中百創S1000空間數據分析得到的細胞空間分布圖由百創開發軟件BSTCellViewer展示。
研究背景
透明腎細胞癌ccRCC是腎細胞癌RCC的常見亞型,是腎癌相關死亡的主要原因,治療手段包括腎切除手術、靶向治療和免疫治療,但多數患者不能從免疫治療獲益,這與腫瘤微環境異質性有關,因此有必要深入理解ccRCC的腫瘤微環境,助力開發新型個性化診療方案。
材料及方法
研究材料:15名腎切除術的ccRCC患者組織樣本及其血液PBMC。對組織樣本區域進行定義,分為腫瘤核心(TC),腫瘤-健康交界(IF,包括腫瘤邊緣TR和臨近健康腎組織AN),遠端健康腎組織DN。
組別設計:實驗組4名ccRCC患者樣本進行單細胞轉錄組測序&空間轉錄組測序,驗證組15名ccRCC患者樣本進行流式細胞術&多重免疫熒光染色,151名ccRCC患者組織樣本&40名其他腎癌亞型患者組織樣本&6名捐獻者健康腎組織進行多重熒光免疫組化染色。
研究方法:單細胞轉錄組測序(4名患者不同區域腫瘤組織,按照CD45+細胞:CD45-細胞=9:1增加免疫細胞數據占比,n=12),空間轉錄組測序(n=4);流式分選,RT-qPCR,Western blot,免疫組化,多重免疫組化,細胞實驗。
研究結果
1.ccRCC組織細胞類型全面分析
單細胞轉錄組測序(scRNA-seq)數據顯示不同患者腫瘤組織的免疫微環境細胞組成相似,T細胞占比最高,特別是CD4+ T細胞。腫瘤區域(TC/TR)富集CD3+細胞以及CD8+ T細胞,而CD4+ T細胞基本分布在所有區域。此外,基質細胞和免疫細胞豐度和分布存在差異,TR區域成纖維細胞比例顯著低于TC區域和AN區域,這一發現也在空間轉錄數據中得到印證。
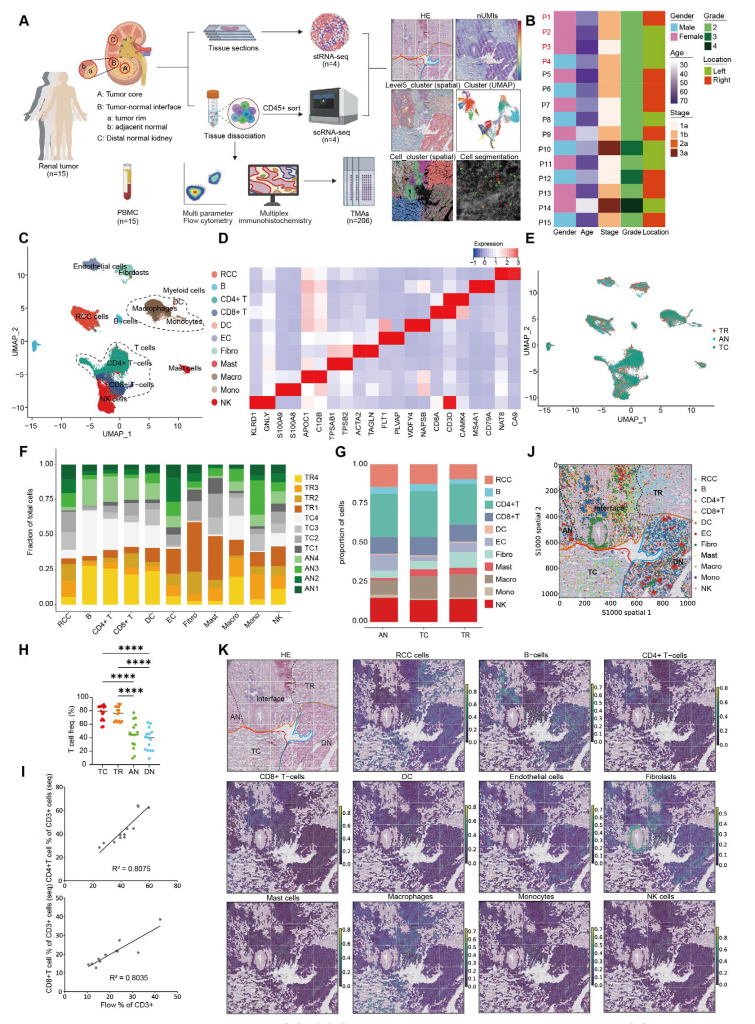
圖1-ccRCC組織中細胞群的全面分析
2.ccRCC細胞元程序的豐度以及異質性
通過非負矩陣因子分解分析每個樣本scRNA-seq數據,得到可以代表ccRCC腫瘤細胞簇元程序的6個基因集,不同基因集代表著不同的程序,如基因集1代表著EMT(上皮-間充質轉變)相關基因表達譜,基因集5也與EMT相關但與基因集1不同的是其包含VEGFA等。
進一步分析,發現ccRCC亞群0~4簇與不同基因集表達譜匹配,5和6簇不與任何基因集匹配但具有細胞周期和應激響應相關基因表達。RCC0簇和RCC2簇代表EMThigh腫瘤細胞并在IF區域富集,RCC1簇代表PT(近曲小管)細胞,擬時序分析結果顯示存在RCC0—>RCC2分化關系,但RCC2幾乎只在P2患者樣本中發現,表明RCC2可能與個別患者特征相關。RCC1、RCC3和RCC4細胞主要在組織而不是腫瘤區域富集,RCC4主要分布在AN和DN區域,RCC4在AN區域分布數量高于DN區域。RCC4高表達細胞因子受體基因,表明TME中分泌的促腫瘤細胞因子可能傾向于作用到RCC4,增加其轉變成癌細胞的概率,加速腫瘤逃逸,促進腫瘤惡性化,與以往瘤旁附近不是完全的健康組織認識相符合。
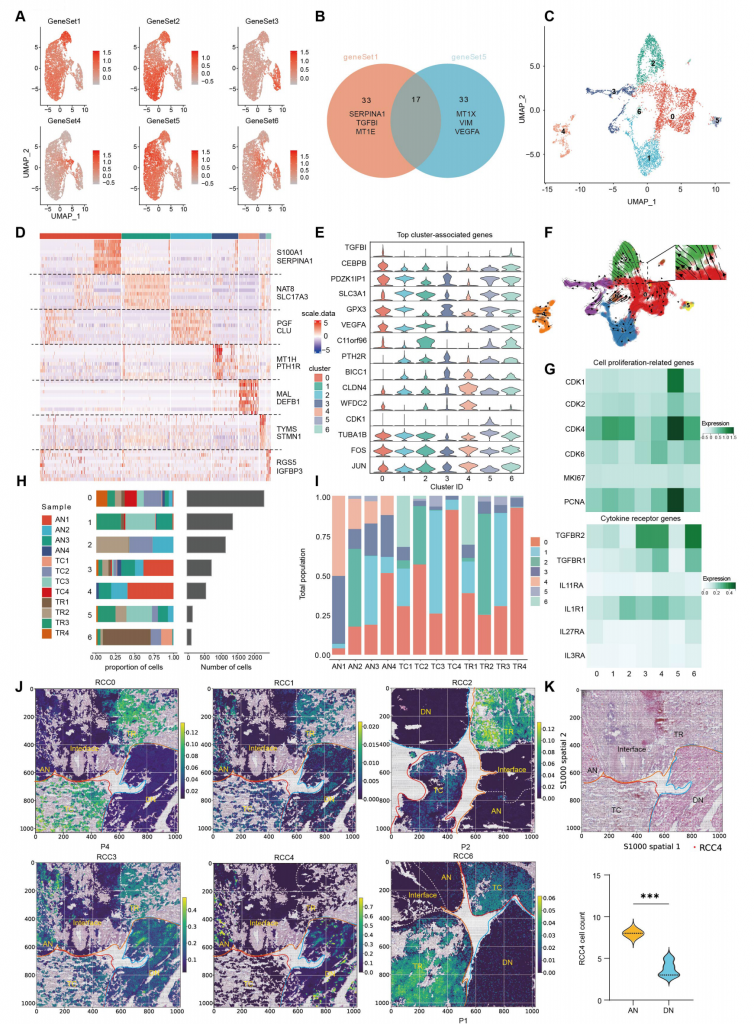
圖2-透明細胞RCC細胞元程序的豐度及異質性
3.ccRCC基質細胞的區域化特征和異質性
scRNA-seq與空間數據均顯示,ccRCC存在8種激活的成纖維細胞簇,腫瘤區域成纖維細胞數量高于健康組織,其中CD24+IL32+成纖維細胞顯著富集在腫瘤區域,PTGDS+成纖維細胞幾乎全分布在AN,高表達ECM(胞外基質)形成和EMT的成纖維細胞簇在IF較為富集,IL1R1+?CAF(腫瘤相關成纖維細胞)表現出腫瘤促進表型;7種EC(內皮細胞)簇中4種(0,2,3和6)主要富集在腫瘤組織,3種(1,4和5)在健康組織富集,膠原蛋白EC(0簇)豐度最高,具有促腫瘤特征。總之,不同的ECM蛋白質產生基質細胞傾向于富集在IF并共定位,可能行駛多種功能,包括細胞-細胞交互和胞外組分重構。
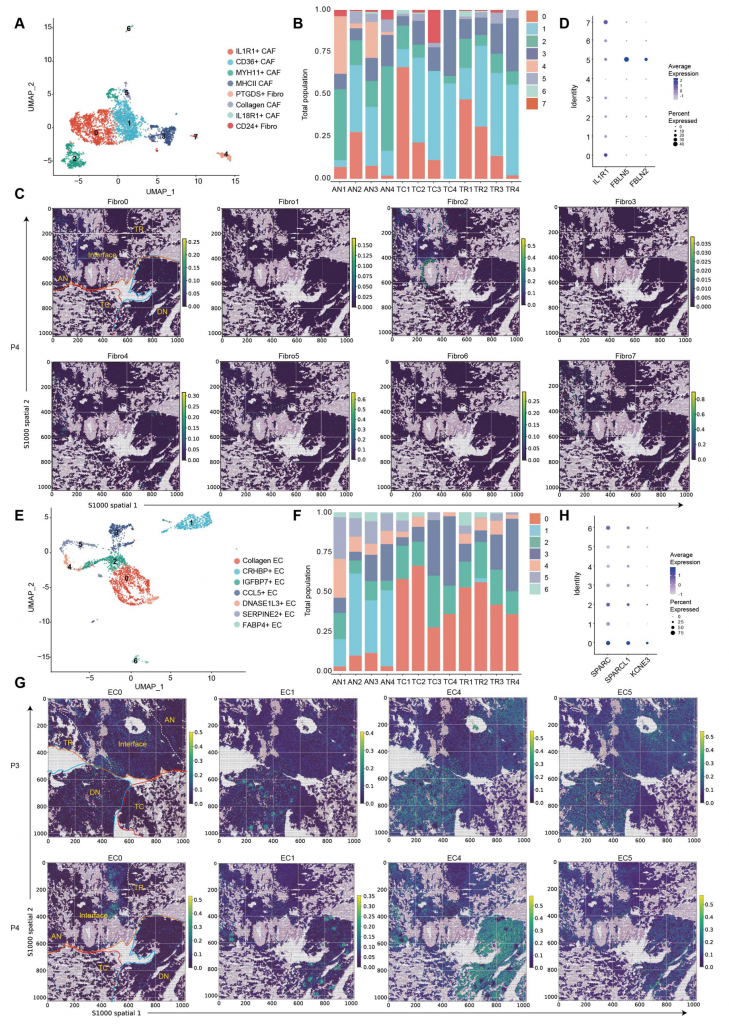
圖3-透明細胞腎細胞癌中基質細胞的區域特征和異質性
4.ccRCC中MRC1+FOLR2+?TAM傾向于表現出更強的促癌表型
scRNA-seq數據與空間數據均顯示,4種TAM簇具有不同分布趨勢,TAM1主要分布在TC區域;TAM2高表達FOLR2、MRC1和CD163,可能是M2樣巨噬細胞且具有增強的免疫抑制特征,TAM4是組織駐留巨噬細胞,兩者主要分布在TR區域;TAM3表達炎癥響應相關基因,在TR和AN區域富集。RNA速率分析顯示存在TAM4—>TAM2—>TAM1和TAM4—>TAM3兩種軌跡,以及從IF區域遷移到TC區域的趨勢。進一步的功能分析顯示,IF區域的TAM2可能通過促進EMT,TC區域的TAM2可能通過促進腫瘤血管生成,起到促癌效應。總之,TAM2不同的腫瘤促進效應可能與免疫抑制TME有關。
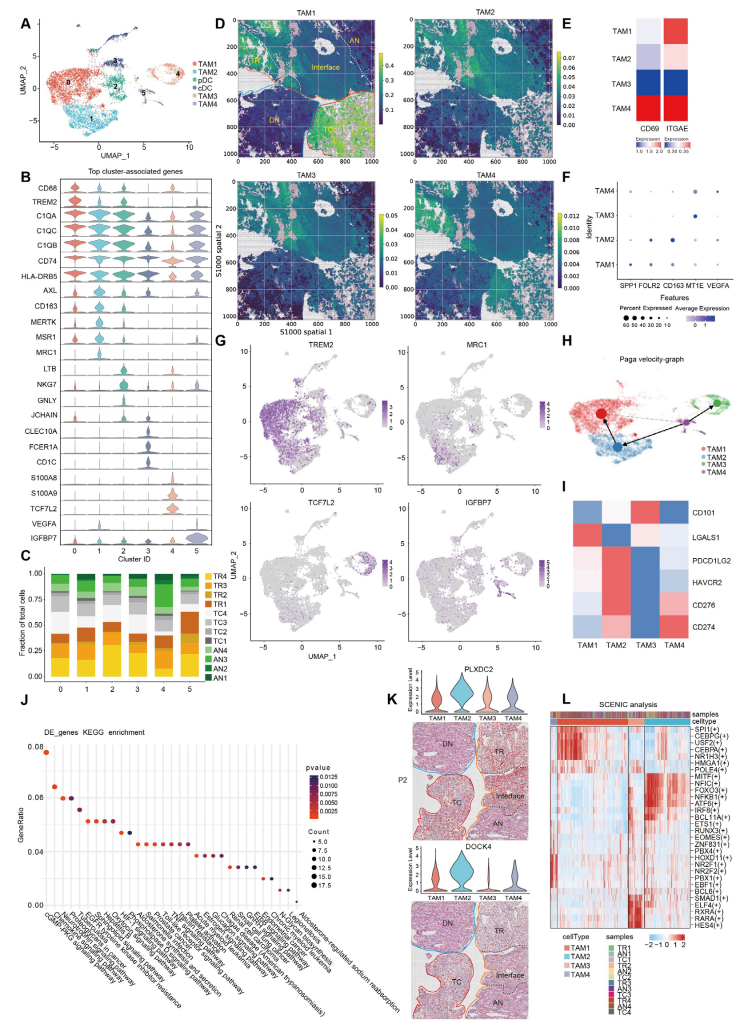
圖4-透明細胞腎細胞癌中MRC1+FOLR2+?TAM傾向于表現更強的促癌表型
5.單細胞分析揭示ccRCC中存在表達IL1B的Treg
進一步分析CD4+ T細胞簇,發現存在CD4+ 初始T細胞、Treg和濾泡樣輔助T細胞,不同簇的特征基因和空間分布模式不同,IF區域富集CD4+ 初始T細胞和PDE3B+ CD4+ T細胞,腫瘤區域富集Treg。其中,TC/TR區域CTLA-4+?Treg的占比以及Treg的FoxP3蛋白表達水平高于AN/DN區域,而CTLA-4+FoxP3-?Treg在所有組織中的分布較為均勻,表明腫瘤區域Treg細胞具有更強的免疫抑制功能。
進一步分析Treg細胞簇,發現存在6種亞型,其中終末效應Treg細胞(5)主要分布在IF區域,FOXP3表達水平較低且ICOS表達水平降低,表明細胞可能處于不穩定狀態。
此外,終末效應Treg細胞表達炎癥性細胞因子如IL1B,IL18和IL7,驗證隊列的多重免疫熒光染色結果顯示IL-1β+終末效應Treg是對ccRCC特異性腫瘤微環境信號的特異性響應。發現腫瘤組織中存在表達炎癥性細胞因子IL1B的終末效應Treg細胞。
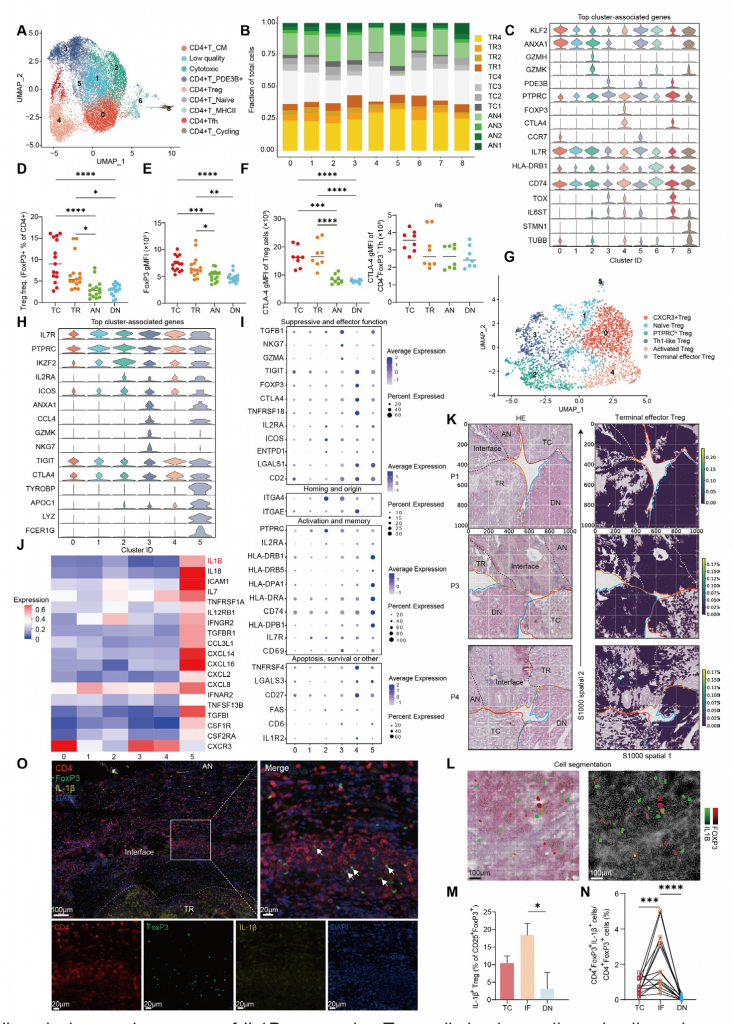
圖5-單細胞分析揭示透明細胞腎細胞癌存在表達IL1B的Treg細胞群
6.IL-18通過ERK/NF-κB通路促進強免疫抑制功能的終末效應Treg細胞產生
空間轉錄組數據結果顯示不同Treg細胞100μm范圍內激活的CD4+/CD8+ T細胞數量較少,終末效應Treg細胞100μm范圍內CD4+/CD8+ T細胞數量更少,表明終末效應Treg細胞周圍應答Treg細胞(Tresp)增殖受到更強的抑制。細胞共培養實驗表明終末效應Treg細胞具有強免疫抑制功能。RNA速率分析結果表明效應終末Treg可能由初始Treg細胞分化而來,體外實驗表明IL-18可刺激CD4+CD25+ Treg細胞上調IL-1β表達,表明終末效應Treg細胞產生和作用可能與IL-18有關。ERK激活劑/NF-κB激活劑促進IL-18+ Treg細胞的產生,IL-18處理后Treg細胞ERK/NF-κB磷酸化水平增加,ERK抑制劑可抑制Treg細胞表達NF-κB但NF-κB抑制劑無法抑制ERK表達,綜上,這些結果表明IL-18可能通過ERK/NF-κB通路介導終末效應Treg細胞的產生。
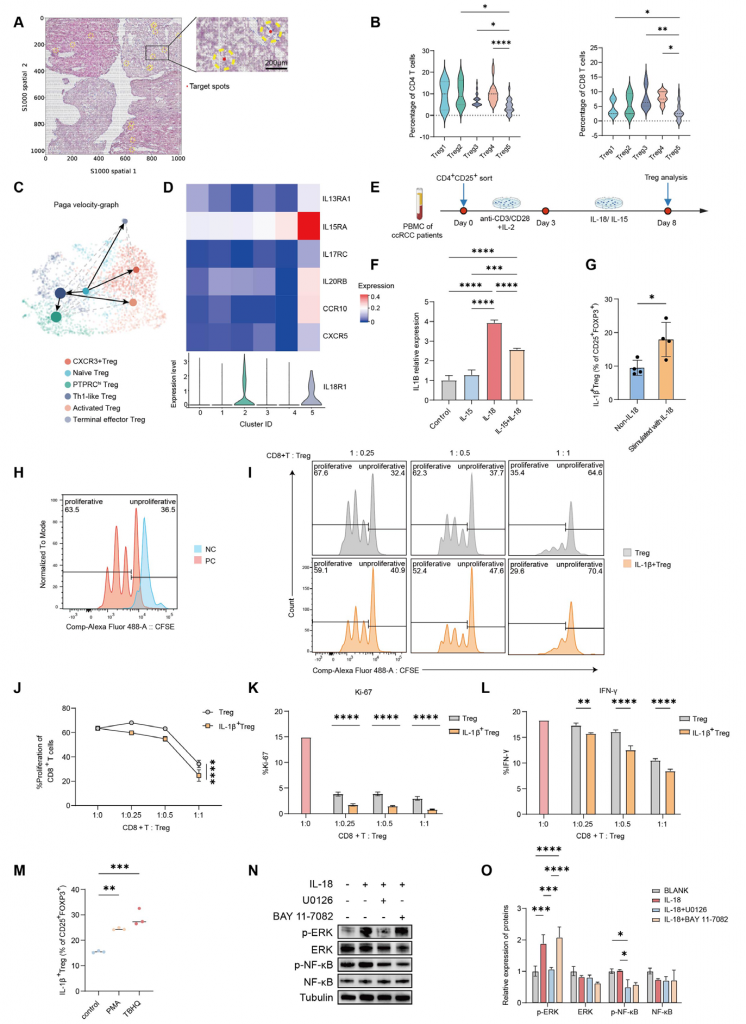
圖6-IL-18通過ERK/NF-κB通路促進具有強免疫抑制功能的終末效應Treg細胞產生
7.通過與MRC1+FLOR2+?TAM互作,終末效應Treg細胞與存活率降低、免疫逃逸增加及腫瘤生長相關
確定終末效應Treg細胞標志基因(FOXP3、IL1B和FCER1G),TGCA泛癌數據庫數據分析結果顯示,終末效應T細胞浸潤高的隊列與更低的整體存活率相關。細胞通訊分析結果顯示,巨噬細胞與終末效應Treg細胞有著最多的互作配體-受體對,許多是免疫抑制互作,驗證實驗支持終末效應Treg細胞與TAM2簇之間存在相互作用;IL1R1+?CAF與終末效應Treg細胞也存在潛在聯系。僅在TC區域(與TR區域相比)發現NAMPT-INSR和TGFB1-(TGFBR1+TGFBR2)配受體互作,體外實驗發現終末效應Treg細胞LRRC32(該基因編碼的GARP是TGF-β1成熟和激活所必須的)表達水平高于傳統Treg細胞。
此外,巨噬細胞特別是TAM2高表達IL18。這些結果可能表明ccRCC腫瘤微環境中,IF區域終末效應Treg細胞與臨近TAM2互作,通過分泌的TGF-β1、M-CSF1以及IL-10,將IF駐留的TAM轉變成促癌表型,引起腫瘤細胞EMT;TAM2分泌的趨化因子誘導Treg細胞遷移到腫瘤區域并過表達IL-18,將Treg細胞轉變成IL-1β+ 終末效應T細胞,抑制T細胞免疫并促進腫瘤生長。
總之,這些結果表明ccRCC的IF區域,終末效應Treg細胞可能與其他促癌細胞互作,最終促進腫瘤細胞惡性轉化,支持了終末效應Treg細胞具有免疫抑制和促癌作用的假設。
研究結果
該研究系統描述了ccRCC中不同類型細胞的基因表達譜和空間分布規律,發現一種具有癌癥促進作用的新Treg細胞亞型,在腫瘤-健康組織交界區域與MRC1+FOLR2+?TAM互作,構建免疫抑制TME,促進腫瘤細胞惡性轉化最終引起患者存活率降低。同時,這些發現也為開發新的藥物和預后標志物提供了靶點。
參考文獻:
Song X, et al. Spatial and single-cell transcriptomics reveal cellular heterogeneity and a novel cancer-promoting Treg cell subset in human clear-cell renal cell carcinoma. J Immunother Cancer. 2025 13(1):e010183.
]]>
2025年3月,華中科技大學同濟醫學院附屬同濟醫院器官移植研究所蘭培祥教授、陳知水教授和肝臟外科程琪教授研究團隊在Journal of Hepatology發表題為”Sour Neuronal Signalling Attenuates Macrophage Mediated Liver Injury”的研究論文。研究使用單細胞轉錄組測序技術等多種技術,深入闡述人鼠中減輕肝缺血再灌注損傷的腦-肝軸調控通路,發現酸味刺激竟然可以通過神經信號緩解肝臟損傷!這一發現不僅為肝臟疾病的治療提供了新思路,還從現代科學的角度驗證了中醫“酸入肝”的理論。
文章標題:Sour Neuronal Signalling Attenuates Macrophage Mediated Liver Injury
期刊名稱:Journal of Hepatology
影響因子:26.7
合作單位:華中科技大學同濟醫學院附屬同濟醫院
百邁客生物為該研究提供了10X單細胞轉錄組測序技術服務。
研究背景
在中醫理論中,酸味與肝臟有著密切的關系。中醫經典《黃帝內經》中提到“酸入肝”,認為酸味食物能夠滋養肝臟,調和氣血,促進肝臟的生理功能。像檸檬、山楂、醋等酸味食物,常被用來調理肝氣郁結、疏肝解郁。這次的研究,不僅讓中醫的古老智慧得到了科學驗證,還為酸味在肝臟疾病治療中的應用提供了新的依據。
肝損傷是多種肝病常見的病理生理基礎,與炎癥有關。肝缺血再灌注損傷是一種局部無菌炎癥響應,主要由先天免疫細胞驅動,是肝切除術中早期器官功能障礙和衰竭的重要原因。傳統認為肝缺血再灌注引起的炎癥是由肝和死亡細胞釋放的DAMP(損傷相關分子蛋白)被肝駐留庫普夫細胞、單核細胞、單核-巨噬細胞等識別,釋放趨化因子和促炎癥因子,招募循環白細胞促使炎癥發生。此外,近年來,神經免疫調控成為研究熱點,科學家們發現,神經系統可以通過釋放神經遞質、神經肽等分子來調節免疫反應。然而,如何通過神經信號來治療肝臟炎癥,仍然是一個未解之謎。
材料及方法
研究方法:單細胞核轉錄組測序(n=3,肝及腹腔神經節),組織學染色,熒光染色,病毒示蹤,免疫印記,免疫沉淀串聯質譜,bulk RNA-seq,qRT-PCR,流式細胞術等。
研究材料:C57BL/6J小鼠缺血再灌注損傷模型,Fam19a2-/-Ccr2-/-小鼠,小鼠海馬神經元細胞系HT122。
研究結果
1.酸刺激減輕肝缺血再灌注損傷
研究者首先構建酸刺激下肝臟缺血再灌注損傷(IRI)小鼠模型,發現酸刺激可以減少肝組織損傷以及血清標志物水平。但是,使用丁卡因局麻小鼠舌頭或者灌胃檸檬酸不能減少肝損傷和血清標志物水平;NMDAR阻斷劑1(阻斷NMDAR介導的興奮性突觸傳遞)立體定位注射到腹后內側核(VPN)后,酸刺激后IRI肝的血清標志物水平和肝損傷程度無明顯變化,表明神經系統在酸刺激減輕IRI過程中起重要作用。此外,小鼠VPN注射示蹤病毒的實驗結果顯示,肝臟以及CG(腹腔神經節)均檢測到熒光,行腹腔神經節切除術能降低IRI肝的組織損傷和血清標志物水平,表明酸刺激減輕肝損傷過程通過腦-CG-肝軸。

圖1-酸通過神經減輕小鼠肝臟缺血再灌注損傷
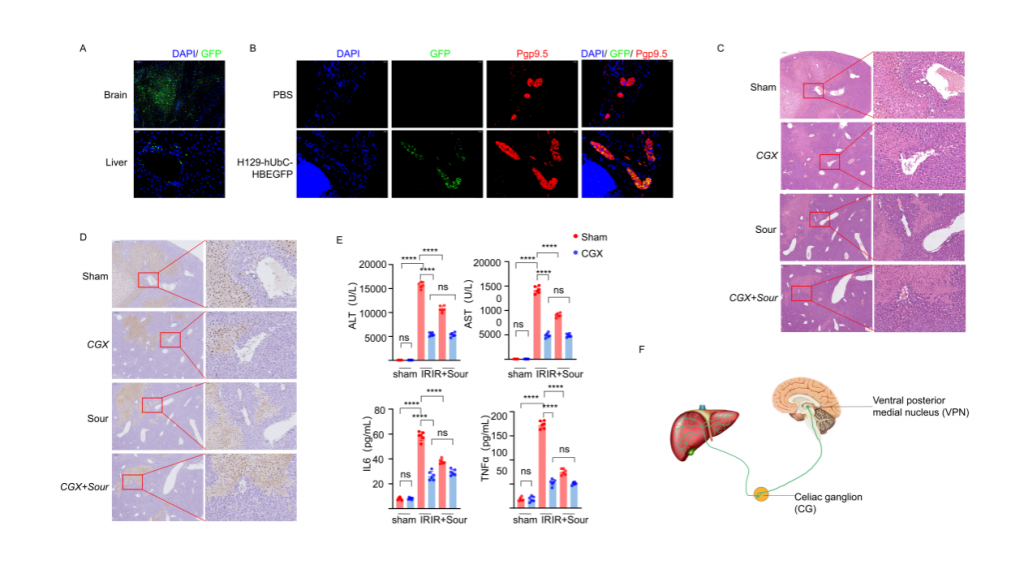
圖2-腦和肝中分布的H129感染神經
2.酸刺激通過減少TAFA2產生降低肝IRI
對肝IRI小鼠、酸刺激后肝IRI小鼠及sham(假手術)小鼠的肝臟和CG進行單細胞核轉錄組測序,結果顯示IRI引起肝細胞和神經元基因表達譜發生變化,IRI肝中免疫細胞數量增加,但酸刺激后IRI樣本中免疫細胞數量減少。神經元較為特異性地表達TAFA2,IRI可引起肝神經元TAFA2表達水平增加,但酸刺激使得TAFA2表達水平降到與sham對照組相近水平。實驗發現鉀離子可引起小鼠海馬神經元細胞系HT22顯著高表達TAFA2,使用鉀離子通道抑制劑可減輕肝損傷,支持酸刺激通過神經系統減輕肝損傷的假設。進一步的,使用慢病毒敲低神經元TAFA2表達水平或使用TAFA2敲基因鼠,發現IRI引起的肝組織損傷、巨噬細胞浸潤以及血清標志物水平降低,表明TAFA2在肝IRI中有著重要作用。

圖3-酸刺激減少小鼠IRI肝中神經細胞Fam19a2表達水平
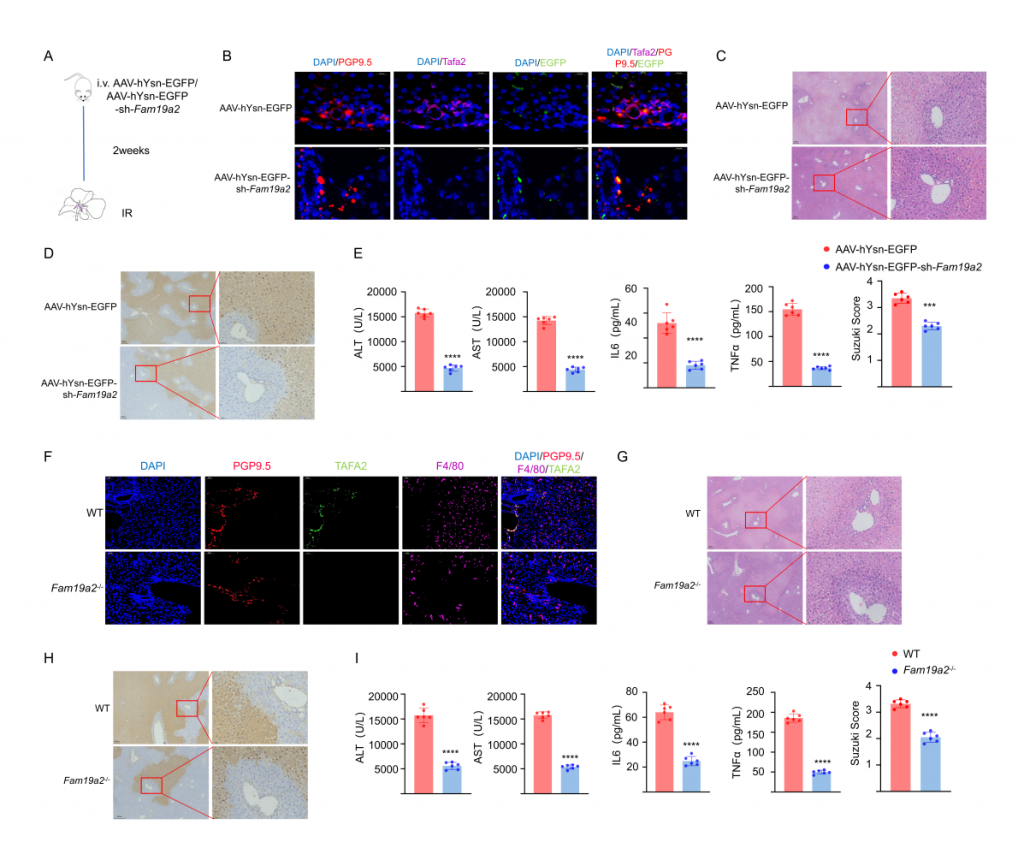
圖4-Fam19a2敲除或敲低,使得小鼠肝臟缺血再灌注損傷降低
?3.IRI肝中TAFA2與巨噬細胞相互作用
體外實驗發現TAFA2不引起肝細胞凋亡;snRNA-seq數據顯示IRI肝中巨噬細胞比例增加且炎癥相關基因表達水平增加,但在酸刺激組中降低;流式細胞術實驗結果表明,TAFA2與巨噬細胞結合而不與T/B細胞結合,不論是否酸刺激T/B細胞比例無顯著變化,IRI肝中CD11b+F4/80low?巨噬細胞增加而酸刺激可降低該巨噬細胞數量;TAFA2敲除或敲低抑制IRI肝中巨噬細胞的浸潤,這些結果表明TAFA2促進巨噬細胞活化。體外實驗結果表明,TAFA2可以激活BMDM(骨髓來源巨噬細胞),引起Il1α,Il1β,Il6和Tnfα的表達,這些結果表明TAFA2激活的巨噬細胞介導了肝IRI。
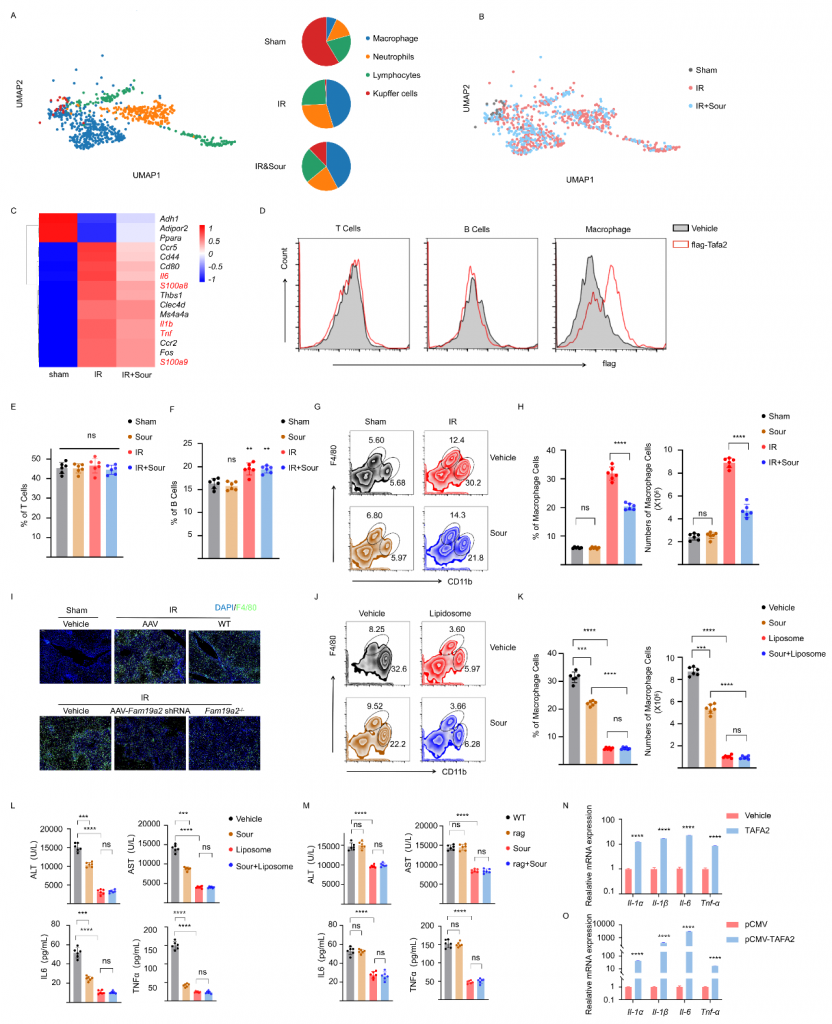
圖5-TAFA2使得IRI中巨噬細胞比例增加,刺激炎性細胞因子的產生
4.TAFA2通過CCR2與巨噬細胞互作
體外實驗表明巨噬細胞上的CCR2是TAFA2受體,CCR2敲除小鼠IRI肝的組織損傷以及巨噬細胞浸潤降低,血清標志物水平降低。TAFA2或CCL2刺激后BMDM的bulk RNA-seq數據表現出幾乎一致的轉錄組表達譜,粘附、代謝、Ras信號通路相關差異基因表達上調,代謝和核糖體通路相關基因表達下調,TAFA2誘導BMDM更高的表達Il1α,Il1β,Il6,Tnfα以及干擾素相關基因,促進巨噬細胞介導的炎癥響應。進一步實驗表明TAFA2促使巨噬細胞介導的炎癥響應主要依賴CCR2,但巨噬細胞上也可能存在其他的TAFA2受體。
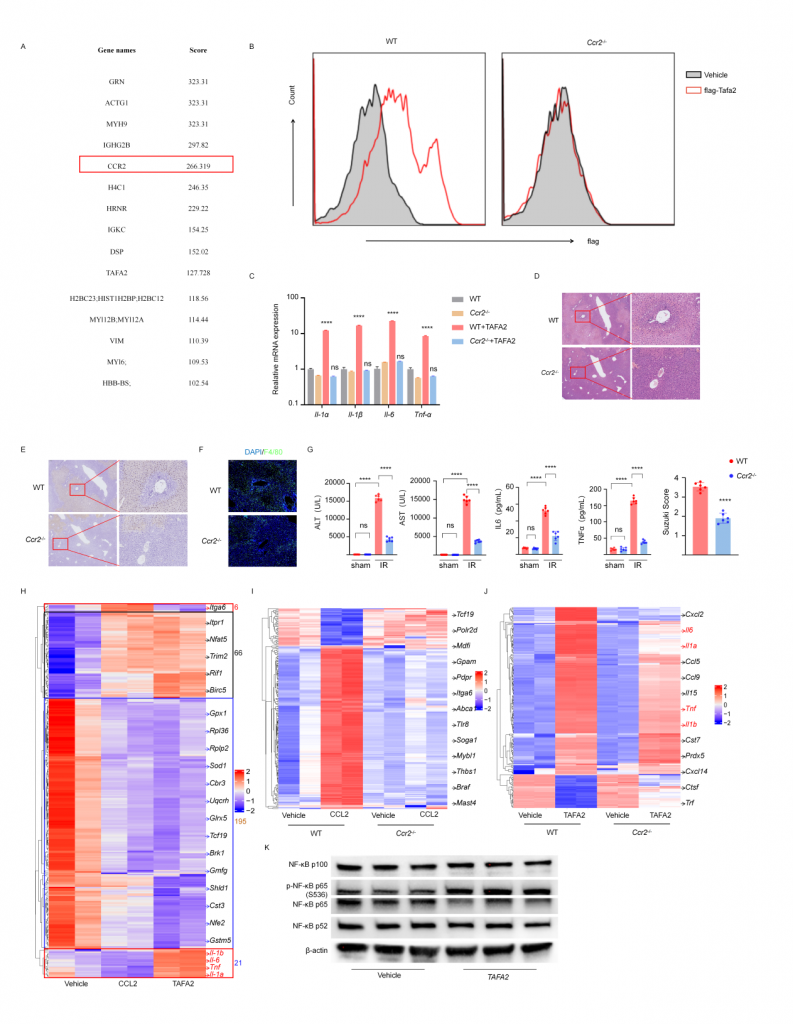
圖6-TAFA2與巨噬細胞表面CCR2互作
5.酸刺激減輕人類肝切除術中肝IRI
為了確認酸刺激在人類肝IRI中的作用,研究者進行了開放、隨機、空白對照臨床試驗(ChiCTR2400088096),包含多種良性/惡性肝腫瘤、肝外傷、膿腫、囊腫和包蟲病,由于手術期間門靜脈短暫阻斷以減少肝切除過程中出血,導致肝出現缺血再灌注損傷。干預組33名患者,術前24h開始,每8h給與新鮮的25mM檸檬酸(持續5min),對照組33名患者不接受酸刺激,剔除6名術中肝缺血超過30min患者以及4名依從性差患者,肝切除術后第1/3/5天對患者肝功能進行評估,結果顯示酸刺激組血清ALT和AST水平顯著低于對照組,高ALT水平(>500 U/L)患者數量也顯著更低,這些結果表明酸刺激可減輕人類肝切除術引起的肝IRI。
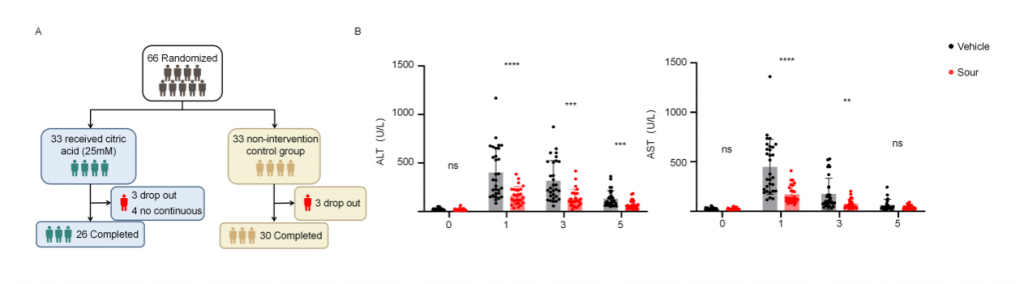
圖7-酸刺激減輕人類肝切除術中肝IRI
研究總結
該研究首次揭示了腦-肝軸在肝臟IRI中的調控作用,闡明了酸味刺激通過神經信號通路緩解肝臟損傷的機制。研究不僅為肝臟IRI的治療提供了新的思路,還為神經免疫調控在其他器官炎癥中的應用奠定了基礎。研究團隊表示,未來將進一步探索神經刺激療法在肝臟疾病中的應用,特別是通過調控腦-肝軸來緩解肝臟炎癥和損傷。此外,研究團隊還將深入研究TAFA2蛋白的作用機制,開發針對TAFA2-CCR2信號通路的靶向藥物,為肝臟疾病的治療提供更多選擇。
]]>

- 發表期刊:Cancer Cell
- 影響因子:48.8
- 發表日期:2025-2-6
- 發表單位:中國醫學科學院腫瘤醫院
- 課題切入點:本文研究了三陰性乳腺癌(TNBC)中不同治療方案對腫瘤免疫微環境(TME)的影響,特別是探討了化療與程序性死亡配體1(PD-L1)阻斷聯合療法的細胞機制。
- 研究?材料?:研究從44名TNBC患者中獲取了78份腫瘤活檢樣本,包括接受nab-紫杉醇(Nab-PTX)聯合阿替利珠單抗(ATZ)、Nab-PTX單藥、紫杉醇(PTX)聯合ATZ以及PTX單藥治療的患者。
- 研究方法?:采用單細胞RNA測序(scRNA-seq)和T細胞受體測序(TCR-seq)技術,對TNBC中的免疫細胞浸潤進行了詳細分析。此外,還利用小鼠4T1乳腺癌模型進行了體內驗證實驗,包括RNA測序和流式細胞術分析。?·?研究結論?:研究發現,不同治療方案下,TNBC中的免疫細胞組成發生顯著變化。Nab-PTX聯合ATZ治療顯著減少了耗竭性CD8+T細胞(Tex)的比例,同時增加了具有干細胞樣特征的中央記憶T細胞(Tcm)和效應記憶T細胞(Tem)的比例。B細胞亞群,特別是濾泡B細胞(Bfoc),在Nab-PTX聯合ATZ治療的響應者中顯著富集,且B細胞水平與有利反應相關。此外,研究還揭示了不同DC亞群之間的轉化關系,以及它們與T細胞反應之間的相互作用。肥大細胞在Nab-PTX相關治療中顯示出增加的趨勢,且其浸潤水平與有利反應相關。體內實驗進一步證實了肥大細胞激活可以增強抗腫瘤免疫反應,從而提高PD-L1阻斷療法的有效性。
這些發現不僅增進了我們對TNBC中免疫細胞動態及其與治療反應之間關系的理解,還為開發新的化療免疫聯合療法提供了潛在的治療靶點。
- 發表期刊:Annals of Oncology
- 影響因子:56.7
- 發表日期:2025-2-4
- 發表單位:英國倫敦癌癥研究所和英國倫敦皇家馬斯登醫院
- 課題切入點:該研究探討了基于全基因組測序(WGS)的超靈敏循環腫瘤DNA(ctDNA)檢測技術在早期乳腺癌分子殘留病灶(MRD)監測和復發預測中的應用。· 研究樣本:研究團隊分析了78例早期乳腺癌患者(包括23例三陰性乳腺癌、35例HER2陽性、18例HR陽性及2例未知亞型)的617份血漿樣本,覆蓋診斷前、新輔助化療期間、術后及長期隨訪(中位隨訪76個月)多個時間點。患者血漿樣本來自英國多家醫療中心,包括診斷前、新輔助化療周期、術后及定期隨訪樣本。
- 研究方法:對腫瘤組織進行全基因組測序(中位深度38×),篩選高可信度體細胞變異構建個性化檢測panel。血漿游離DNA(cfDNA)經高通量測序后,通過分子共識算法抑制背景噪聲,計算ctDNA水平。所有樣本通過NeXT Personal MRD平臺進行檢測,該平臺基于腫瘤組織的全基因組測序數據,為每位患者個性化設計檢測panel,追蹤中位數1451個體細胞變異,檢測靈敏度可達百萬分之一(1 PPM)。
- 數據分析:采用Kaplan-Meier生存分析和Cox比例風險模型評估ctDNA檢測與臨床結局(復發無生存期RFS、癌癥特異性生存期CSS)的關聯,并通過時間依賴性模型動態評估MRD狀態對預后的影響。
- 研究結果:1. 診斷階段:98%(49/50)的患者在治療前檢測到ctDNA,涵蓋所有亞型(HER2+和TNBC均為100%,HR+為88%)。診斷時ctDNA水平升高與較差的RFS(HR=1.82)和CSS(HR=2.19)顯著相關。2. 術后監測:所有復發患者(11/11)在臨床復發前均檢測到ctDNA(中位提前15個月),未檢測到ctDNA的患者(64/64)均未復發。術后ctDNA陽性與RFS和CSS顯著惡化相關(均P<0.0001)。3. 靈敏度優勢:39%的ctDNA陽性樣本處于超低水平(<100 PPM)。與全外顯子測序(WES)和數字PCR(dPCR)相比,WGS方法在匹配樣本中檢測率更高(WGS 100% vs. WES 84% vs. dPCR 76%)。4. 動態預后:術后6周或6個月未檢測到ctDNA的患者預后顯著改善。此外,術后早期ctDNA清除(如輔助治療后)可能提示疾病控制良好。
- 研究結論:WGS驅動的超靈敏ctDNA檢測技術顯著提升了早期乳腺癌MRD監測的敏感性和特異性,可提前預測復發并指導臨床決策。其高陰性預測值(NPV 100%)支持在低風險患者中探索治療降階梯策略,而陽性結果則為早期干預提供了依據。未來需擴大樣本量并開展前瞻性研究以驗證其臨床實用性。
Ps:關注醫學領域腫瘤研究請聯系當地業務經理獲取原文~
]]>
本次為各位老師帶來重慶醫科大學黃愛龍教授/唐開福教授團隊在nature子刊?Nature Communications?中發表的題目為“SARS-CoV-2 N protein-induced Dicer, XPO5, SRSF3, and hnRNPA3 downregulation causes pneumonia”的文章。該文章研究了 SARS-CoV-2 N 蛋白如何影響 RNA 干擾 (RNAi) 和 RNA 剪接途徑,并揭示了這些途徑在 COVID-19 發病機制中的作用,有助于開發更有效的 SARS-CoV-2 相關肺炎治療方法。

中文題目:SARS-CoV-2 N蛋白誘導的Dicer、XPO5、SRSF3和hnRNPA3下調導致肺炎
英文題目:SARS-CoV-2 N protein-induced Dicer, XPO5, SRSF3, and hnRNPA3 downregulation causes pneumonia
發表期刊:Nature Communications?
影響因子:14.7
合作單位:重慶醫科大學
百邁客生物為該研究提供了小RNA測序和ONT全長轉錄組測序服務。
研究背景
2019 冠狀病毒病 (COVID-19) 由嚴重急性呼吸系統綜合癥冠狀病毒 2 (SARS-CoV-2) 引起,具有高度異質性,且發病病例分布在各個年齡群體中,但重癥及死亡率明顯字老年群體比較集中。DNA 損傷是導致衰老的關鍵因素,也是 COVID-19 發病機制的驅動因素,蛋白質穩態喪失是衰老的另一個標志,會導致不受抑制的炎性小體激活、功能失調的細胞器積累和細胞損傷,可能導致 COVID-19 的發病機制。Dicer 是 RNA 干擾 (RNAi) 通路的關鍵組成部分,在衰老過程中下調, RNAi 組分的敲除會導致 DNA 損傷,并且可能由于 miRNA的整體下調而增加蛋白質合成,從而影響蛋白質穩態,與年齡相關的剪接因子失調發生在不同生物體的多個組織中,并且與基因組穩定性和蛋白質穩態有關,可通過R環誘導 DNA 損傷。然而,RNAi 成分及RNA 剪接因子在 COVID-19 發病機制中的確切作用還有待明確。
材料和方法
材料:異位表達 N 蛋白的人肺癌 (A549) 和人正常肺上皮 (BEAS-2B) 細胞系 ,N 蛋白誘導的雄性肺損傷小鼠及正常對照 C57BL/6J 雄性小鼠;
方法:小RNA測序+ONT全長轉錄組+免疫組化+RIP等
研究結果
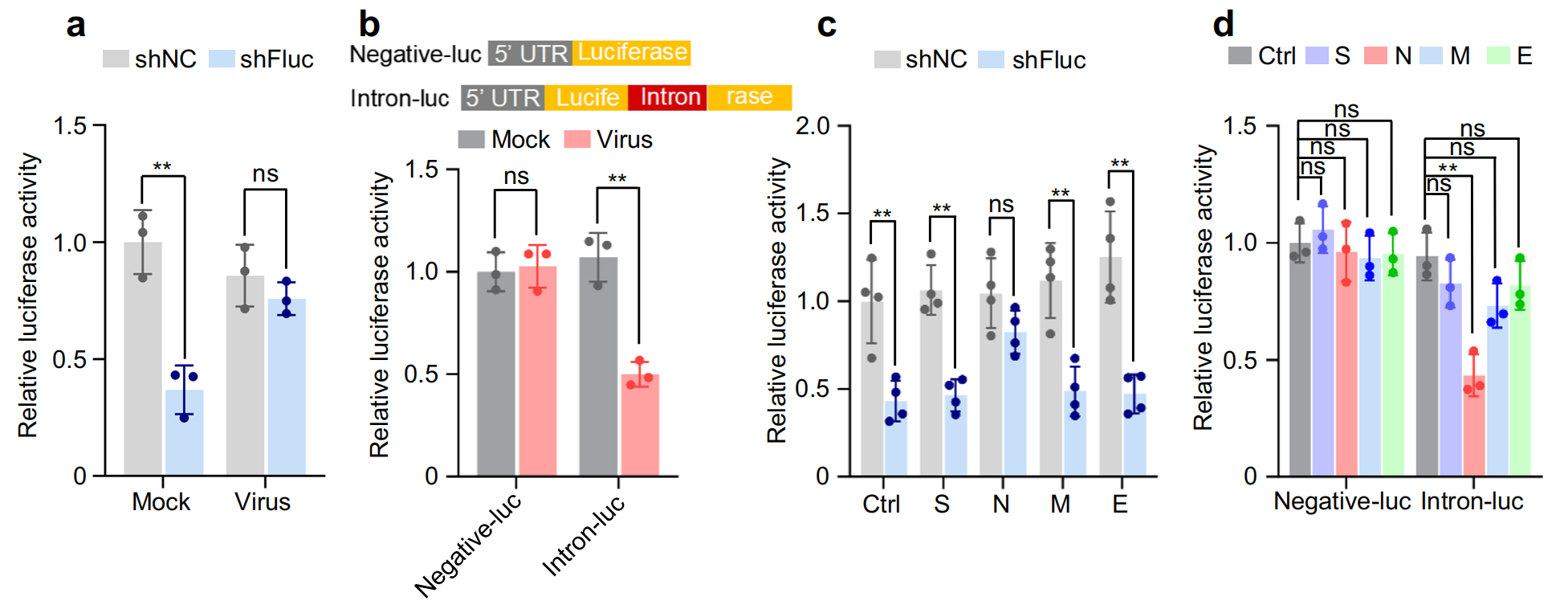
1.SARS-CoV-2核衣殼 (N) 蛋白誘導自噬降解及DNA損傷的作用機制
通過對已發表的COVID-19 患者RNA測序數據的分析,確定了重癥 COVID-19 患者 M-MDSC 中 RNAi 成分和剪接因子的 mRNA 水平低于無癥狀 COVID-19 患者,且已故 COVID-19 患者肺組織中的 RNAi 成分和剪接因子水平也低于未感染 COVID-19 的個體,表明RNAi 成分和剪接因子的表達減少與 COVID-19 感染加重有關。
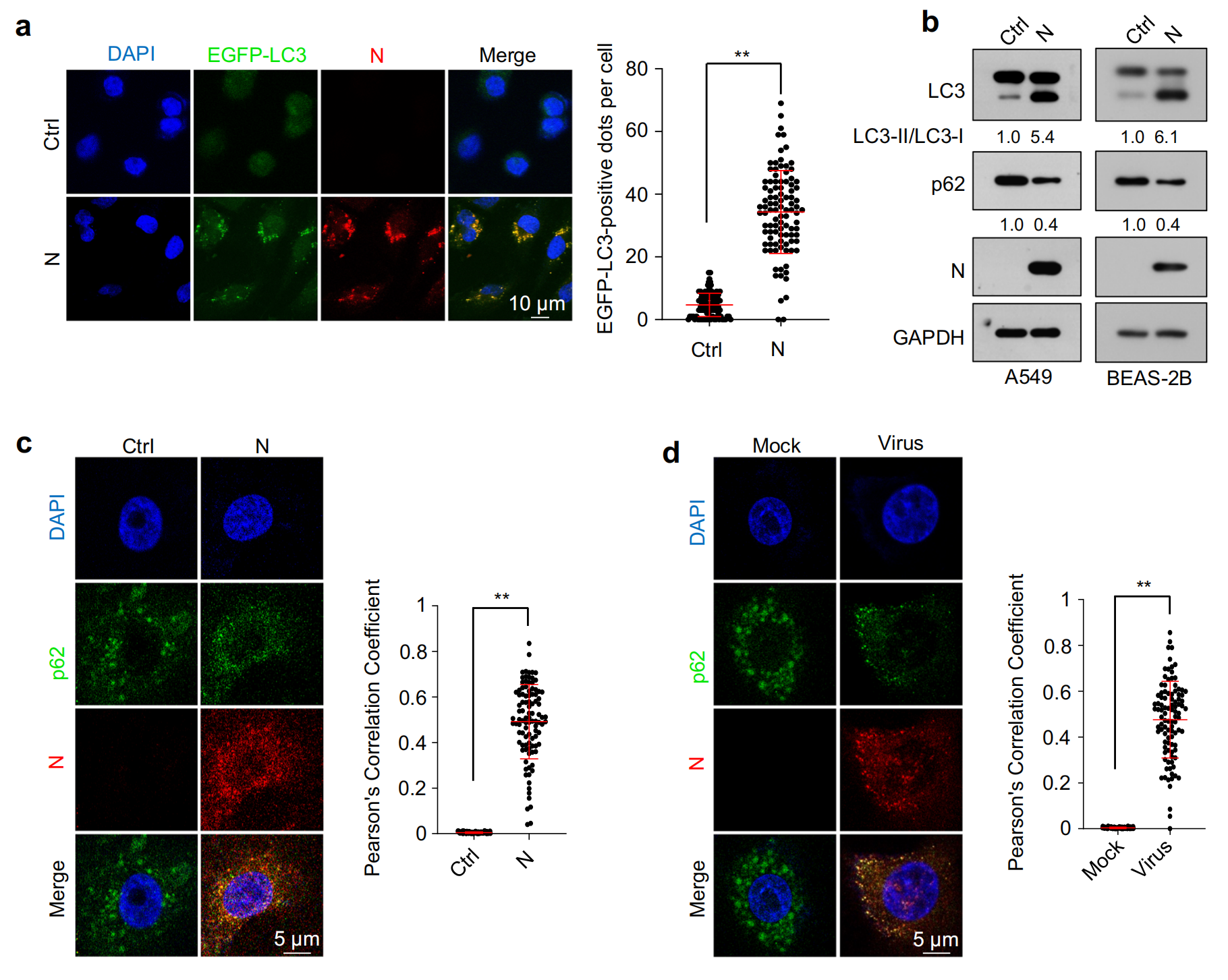
細胞沉默逆轉測定使用含有內含子的熒光素酶報告基因小基因證明了 SARS-CoV-2 抑制了該小基因的剪接。該研究從相互作用數據集的生物通用存儲庫 (BioGRID) 中檢索了 N 蛋白的推定蛋白質相互作用子,并用免疫共沉淀測定證實了異位表達 N 蛋白的人肺癌 (A549) 和人正常肺上皮 (BEAS-2B) 細胞系中 N 蛋白與?Dicer、XPO5、SRSF3和hnRNPA3?之間的相互作用,進一步定量測定結果發現,SARS-CoV-2 感染導致?Dicer、XPO5、SRSF3和hnRNPA3在蛋白水平上下調,但在 mRNA 水平上不下調,而自噬抑制劑氯喹或巴弗洛霉素 A1 治療可緩解 N 蛋白或 SARS-CoV-2 誘導的?Dicer、XPO5、SRSF3?和?hnRNPA3?下調,用蛋白酶體抑制劑 MG132 處理并無效果,表明?N 蛋白對?Dicer、XPO5、SRSF3?和?hnRNPA3?蛋白表達的影響是自噬依賴性的。
在 BioGRID 數據庫中找到了一種自噬受體蛋白SQSTM1/p62 ,共聚焦顯微鏡分析和免疫共沉淀分析分別證實了 N 蛋白和 p62 之間的相互作用及其共定位,p62 敲低部分緩解了 N 蛋白誘導的?Dicer、XPO5、SRSF3?和?hnRNPA3?蛋白的下調;然而,它不會影響不表達 N 蛋白的細胞中的?Dicer、XPO5、SRSF3?或?hnRNPA3?蛋白水平,表明?p62 通過與 N 蛋白的相互作用將 N 蛋白相互作用蛋白(包括?Dicer、XPO5、SRSF3?和?hnRNPA3)募集到吞噬細胞中,導致自噬降解。
ATM等的磷酸化、DNA 斷裂積累等病灶形成證明了異位 N 蛋白表達或 SARS-CoV-2 感染誘導了 DNA 損傷,敲低?Dicer、XPO5、SRSF3?或?hnRNPA3?導致 DNA 損傷,而它們的過表達部分減輕了 N 蛋白誘導的 DNA 損傷,同時異位 N 蛋白表達或 SARS-CoV-2 感染誘導了 R 環積累,進一步誘導DNA損傷,RNase H1(一種降解 R 環的 RNA 部分的核糖核酸內切酶)的過表達部分減輕了這種影響并減少了 DNA 損傷積累,總的來說,這些發現表明?N 蛋白誘導的 Dicer 、 XPO5 、 SRSF3 和 hnRNPA3 表達下調導致 DNA 損傷。
2.SARS-CoV-2 N蛋白通過抑制 miRNA 生物發生及抑制 RNA 剪接作用機制
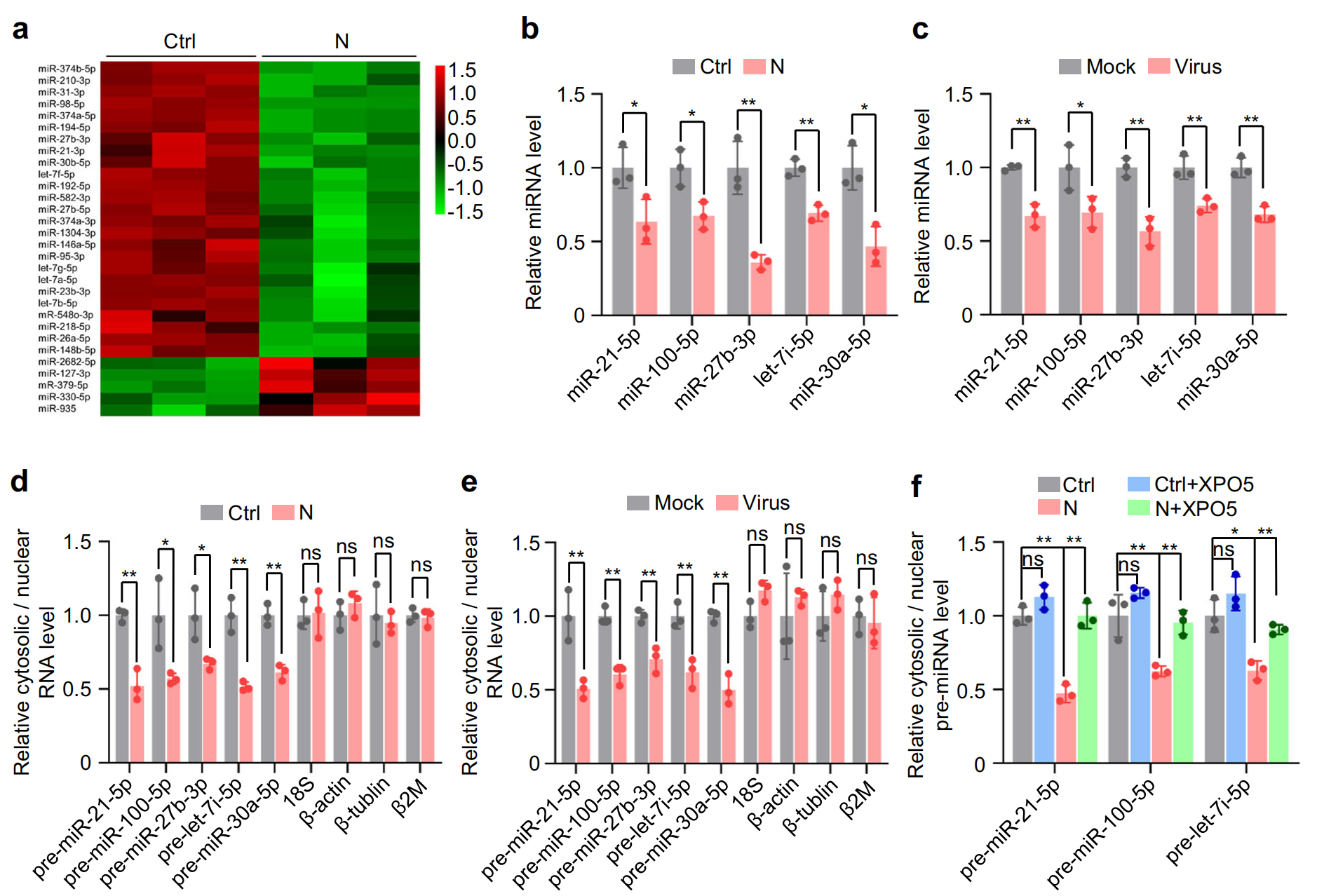
XPO5和Dicer在 miRNA 生物合成中起關鍵作用,小 RNA 深度測序顯示,N 蛋白誘導 miRNA 表達的整體下調,對 A549 和 BEAS-2B 細胞中表達量最高的前五個 miRNA進行定量驗證顯示,它們在表達 N 蛋白的細胞和 SARS-CoV-2 感染的細胞中均下調;生化分級分離實驗顯示,異位 N 蛋白表達或 SARS-CoV-2 感染誘導 pre-miRNA 的核保留,如細胞核中 pre-miRNA 水平的增加和細胞質中 pre-miRNA 水平的降低所示,?XPO5過表達后得到緩解。此外,異位 N 蛋白表達或 SARS-CoV-2 感染降低了成熟 miRNA 和 pre-miRNA 之間的比率,Dicer過表達后得到緩解。總體而言,這些發現表明,N 蛋白通過降低?XPO5?表達阻斷 pre-miRNA 從細胞核到細胞質的運輸,并通過下調?Dicer?表達抑制 pre-miRNA 向成熟 miRNA 的加工。
SRSF3或hnRNPA3敲除抑制了含有內含子的報告基因小基因的剪接,證實了它們確實是剪接因子,而它們的過表達部分緩解了 N 蛋白或 SARS-CoV-2 感染對 RNA 剪接的抑制作用,進一步進行全長轉錄組測序,通過可變剪接分析發現,N 蛋白誘導內含子保留。此外,RT-qPCR證實,異位 N 蛋白表達或 SARS-CoV-2 感染降低了一組內源性內含子的剪接效率,SRSF3?和?hnRNPA3?過表達部分減輕了 N 蛋白和 SARS-CoV-2 對 RNA 剪接的抑制作用,這些結果表明,N 蛋白通過降低?SRSF3?和?hnRNPA3?的表達來抑制 RNA 剪接。
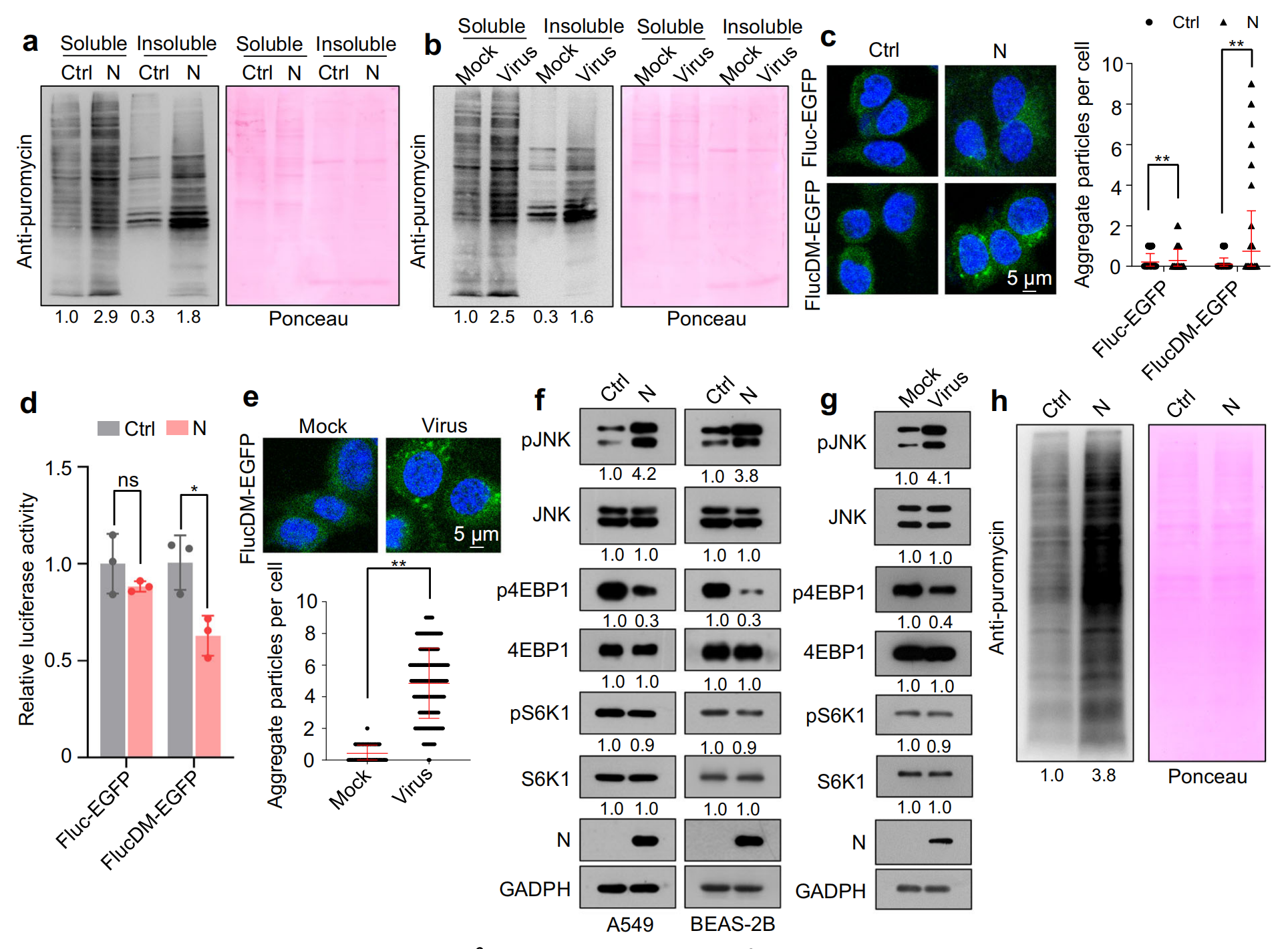
剪接抑制會誘導廣泛的 IR 和隨后的內含子保留 mRNA 的翻譯,一部分內含子衍生的多肽容易縮合且具有蛋白毒性,用嘌呤霉素對新生多肽進行代謝標記,結果顯示異位 N 蛋白表達或 SARS-CoV-2 感染誘導不溶性蛋白合成增加,而N蛋白與RNA的結合主要在可溶性蛋白部分被檢測到,免疫熒光檢測結果表明,N 蛋白和 SARS-CoV-2 感染誘導了 EGFP 聚集體的產生,誘導蛋白毒性應激。
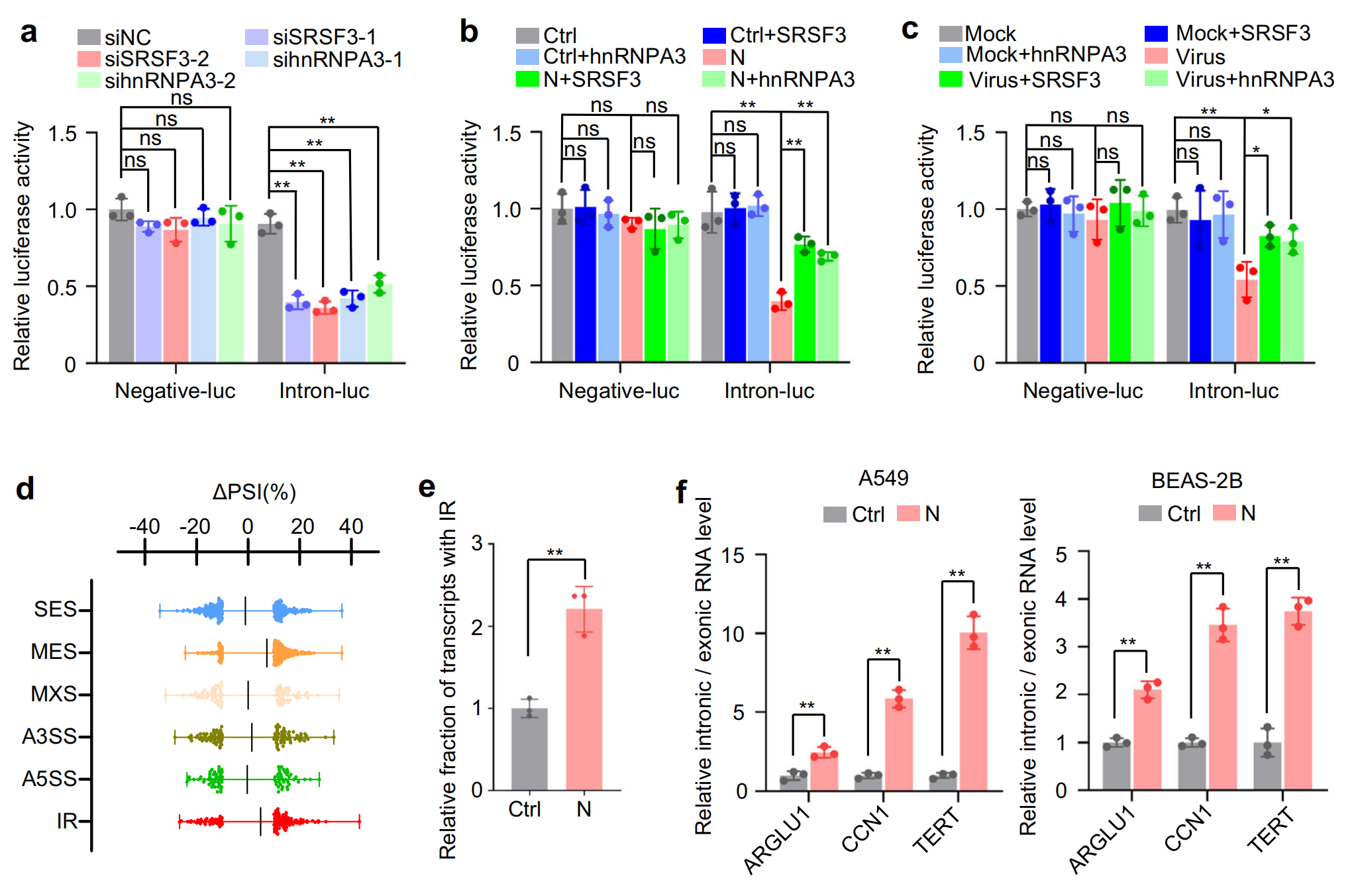
3.SARS-CoV-2 N 蛋白在蛋白水平的影響及動物模型驗證
盡管異位 N 蛋白表達或 SARS-CoV-2 感染導致 4EBP1 去磷酸化,但它增加了整體蛋白質合成,而沒有顯著影響 S6K1 磷酸化,對照組的刺突蛋白和膜蛋白對整體蛋白質合成沒有影響,而包膜蛋白甚至抑制了整體蛋白質合成,Dicer?或?XPO5?敲低導致 JNK 激活和 4EBP1 去磷酸化,同時略微增加 S6K1 磷酸化并促進蛋白質合成,表明 N 蛋白通過降低?Dicer?和?XPO5?表達來促進蛋白質合成,并通過下調?SRSF3?和?hnRNPA3?表達來抑制蛋白質合成。由于?Dicer?和?XPO5?的下調比?SRSF3?和?hnRNPA3?的下調更顯著地促進蛋白質合成,因此 N 蛋白最終增強了蛋白質合成。
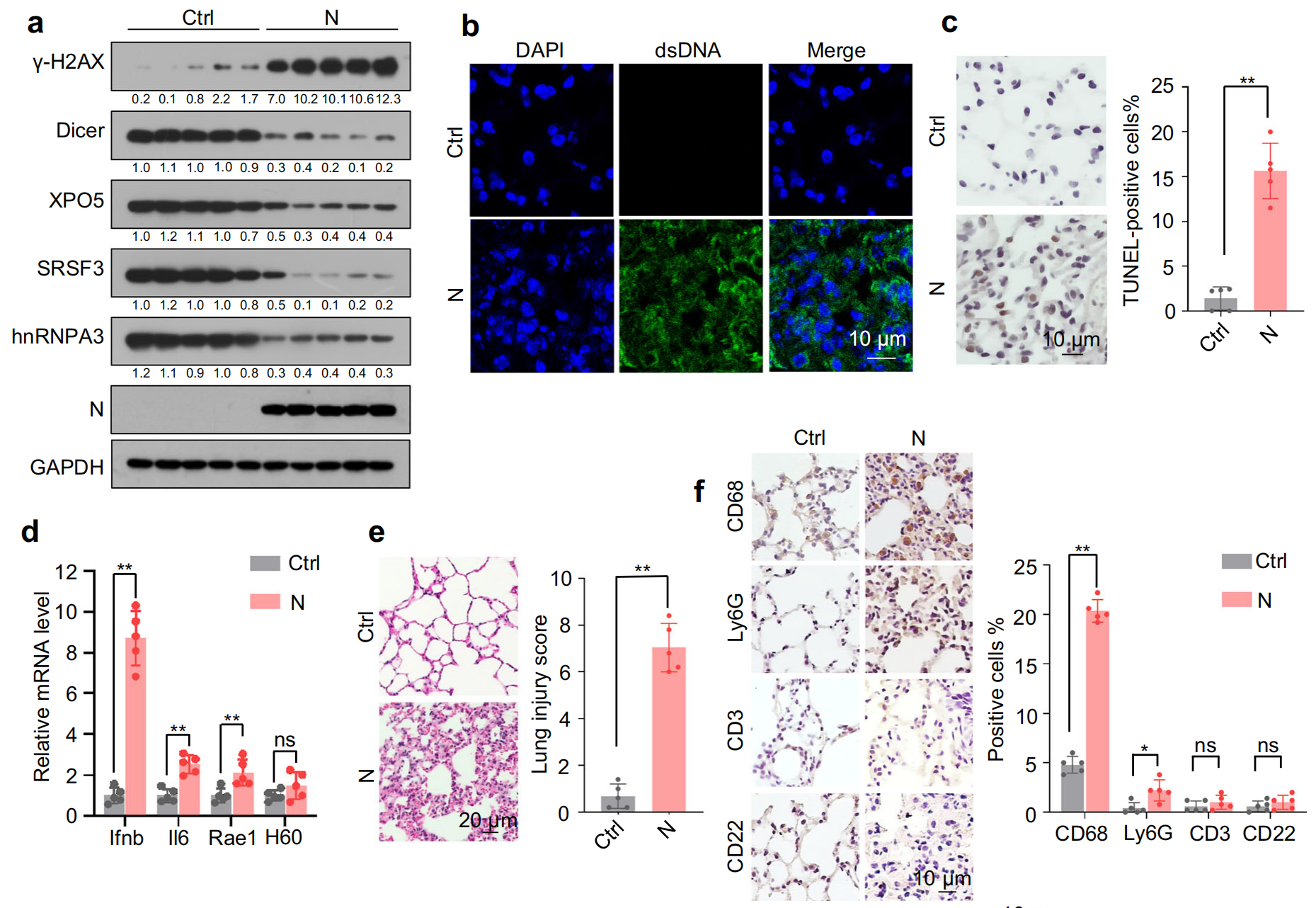
小鼠體內驗證結果顯示, N 蛋白在小鼠肺組織中的表達導致?Dicer、XPO5、SRSF3?和?hnRNPA3?下調、DNA 損傷、胞質 DNA 積累、細胞凋亡、IFNβ、IL-6 和 NKG2D 配體上調,以及伴有明顯巨噬細胞浸潤的肺炎,肺組織中?Dicer、XPO5、SRSF3?和?hnRNPA3?敲低導致肺損傷和肺炎,而它們的過表達部分緩解了 N 蛋白誘導的肺炎,這些結果表明,N 蛋白誘導的?Dicer、XPO5、SRSF3?和?hnRNPA3?蛋白表達下調是 SARS-CoV-2 誘導肺炎的一種機制。
分析已發表的 3、6、12 和 24 個月齡 C57BL/6J 小鼠肺組織的 RNA 測序數據,在 8 周齡和 18 個月齡 C57BL/6J 小鼠的 mRNA 和蛋白質水平上證實了肺組織中?Dicer、XPO5、SRSF3?和?hnRNPA3?的年齡依賴性下調, DNA 損傷、細胞凋亡等功能在老年小鼠中明顯富集,結合Dicer、XPO5、SRSF3?和?hnRNPA3?敲低實驗,表明,Dicer、XPO5、SRSF3?和?hnRNPA3?的年齡相關下調與 N 蛋白誘導的肺炎嚴重程度增加有關。
PJ34 是一種(ADP-核糖)聚合酶 (PARP) 抑制劑,免疫沉淀結果表明 PJ34 通過阻止 N 蛋白誘導的?Dicer、XPO5、SRSF3?和?hnRNPA3?的下調來緩解肺炎,阿那曲唑是一種增強 Dicer 表達的芳香化酶抑制劑,WB結果表明,阿那曲唑通過促進?Dicer、XPO5、SRSF3?和?hnRNPA3?的表達來緩解 SARS-CoV-2 N 蛋白誘導的肺炎。
思路發散
本研究通過數據庫檢索及分子實驗驗證先初步推測SARS-CoV-2 N蛋白的年齡依賴調控機制與RNAi以及可變剪接相關,之后通過組學測序在整體水平上驗證了猜測并進一步細化了調控方式,之后再通過大量過表達及敲降后對應分子在RNA及蛋白水平的定量驗證了結果,是一個比較經典有效的實驗思路,可以在其他實驗中參考。
參考文獻:
Luo YW, Zhou JP, Ji H, Xu D, Zheng A, Wang X, Dai Z, Luo Z, Cao F, Wang XY,Bai Y, Chen D, Chen Y, Wang Q, Yang Y, Zhang X, Chiu S, Peng X, Huang AL, Tang KF. SARS-CoV-2 N protein-induced Dicer, XPO5, SRSF3, and hnRNPA3 downregulation causes pneumonia.?Nat Commun. 2024 Aug 13;15(1):6964. doi:10.1038/s41467-024-51192-1.
]]>本期為各位老師帶來一篇關于小RNA及lncRNA研究的高分經典案例解讀,希望能為各位老師后續研究激發新的研究思路~
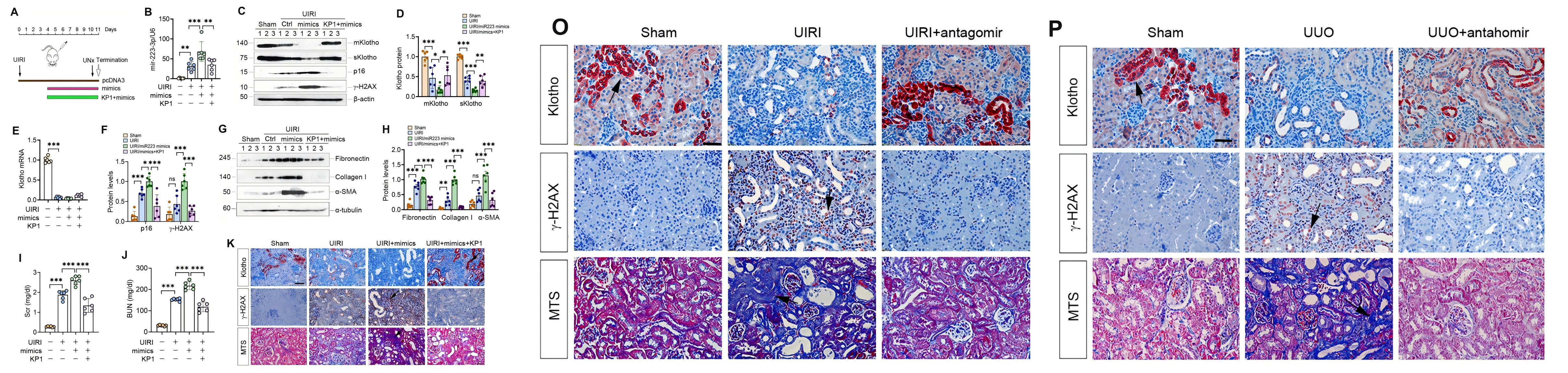
 中文題目:Klotho衍生肽1通過轉錄后調控恢復Klotho表達抑制纖維化腎臟細胞衰老
中文題目:Klotho衍生肽1通過轉錄后調控恢復Klotho表達抑制纖維化腎臟細胞衰老
英文題目:Klotho-derived peptide 1 inhibits cellular senescence in the fibrotic kidney by restoring Klotho expression via posttranscriptional regulation[2]
合作單位:南方醫科大學
發表期刊:Theranostics?
影響因子:12.4
百邁客生物為該研究提供了miRNA測序服務。
研究背景
慢性腎病(CKD)是一種持續 3 個月以上的腎功能不全病癥,特征通常是細胞衰老增加、表觀遺傳重編程、持續的成纖維細胞活化和持續的細胞外基質(ECM)產生,與老年腎臟存在很多相似之處,因此,CKD現在被認為是一種腎臟過早和加速衰老的狀態。抗衰老蛋白 Klotho 屬于由α和β亞型組成的單跨膜蛋白小家族,腎損傷會導致Klotho表達下調,Klotho 缺乏可導致高磷血癥、腎小管細胞衰老和腎纖維化等,進一步加速 CKD的進展,因此Klotho 被認為是腎臟疾病診斷和預后的潛在生物標志物和治療靶點。
然而由于Klotho 是一種大型跨膜蛋白,臨床生產成本高且難度大,因此作者團隊在前期報道了Klotho衍生肽1(KP1) 的發現,可通過結合TGF-β 受體2(TβR2) 并抑制 TGF-β/Smad3 信號轉導來減輕腎纖維化,且生產上會更便捷經濟,有可能替代 Klotho 進行臨床轉化,為了進一步研究 KP1 在保護腎臟中的作用,作者在本篇研究中檢查了其對細胞衰老的影響。
材料方法
材料:8-10周齡雄性C57BL/6小鼠假手術組(sham)、單側缺血再灌注損傷(UIRI)組別小鼠和治療組別小鼠(UIRI + KP1)共三組小鼠腎臟組織;
方法:miRNA測序+雙熒光素酶報告基因檢測+RNA 熒光原位雜交等
研究結果
WB檢測了許多細胞衰老標志物如p21、p16和γ-H2AX的表達,結果表明了UIRI 誘導纖維化腎中對應標志物的表達,而KP1明顯消除了這種誘導。此外針對其內源Klotho 的檢測也證明UIRI 導致腎臟中Klotho 的丟失而KP1在很大程度上恢復了它們的表達,單側輸尿管梗阻(UUO)誘導的 CKD 模型以及體外細胞模型中也出現了類似的結果,此外,UIRI 還導致 Klotho mRNA 的顯著下調。然而,KP1 不影響 Klotho mRNA 的穩態水平,說明KP1通過獨立于轉錄調控的機制誘導 Klotho。
此外,通過流式細胞術進行的細胞周期分析表明,TGF-β1 孵育后的衰老原代腎小管細胞停滯在 G1 期,這被 KP1 處理抵消,證明了KP1阻斷細胞衰老的能力,而在可以阻斷新mRNA合成的放線菌素D(ActD)存在下與 TGF-β1 孵育后 12 小時和 24 小時,KP1 不會影響 Klotho mRNA 水平,進一步證實了 KP1 誘導 Klotho 蛋白表達而不影響其mRNA和蛋白質穩定性。
由于 KP1 不影響 Klotho mRNA 水平和蛋白質穩定性,作者開始探索 KP1 是否通過miRNA調節 Klotho 蛋白,在 UIRI 腎臟中鑒定到了68個上調miRNA,在注射 KP1 后恢復到基線,其中 10 個與 Klotho mRNA 的 3′-UTR 特異性結合,其中miR-223-3p表現非常明顯,且在對公共轉錄組數據集分析后發現,miR-223-3p 與 Klotho 水平呈負相關,支持了 miR-223-3p 與 Klotho 調節的相關性。
為了證實 miR-223-3p 在 Klotho 表達中的調節作用,作者進行了雙熒光素酶報告基因測定,轉染 miR-223-3p 模擬物降低了含有野生型未突變型 Klotho mRNA 序列的報告基因的熒光素酶活性,表明 miR-223-3p 可以特異性靶向 Klotho mRNA,抑制其活性,用miR-223-3p轉染HK-2細胞進一步證明miR-223-3p抑制 HK-2 細胞中 Klotho 蛋白的表達。體內模型原位雜交驗證了miR-223-3p 在 UIRI 腎腎小管上皮中被誘導,而KP1抑制了miR-223-3p表達,結合免疫熒光染色結果證明了KP1 可以通過在體內抑制 miR-223-3p 來恢復 Klotho 表達,在體外的HK-2 細胞中的miR-223-3p及其拮抗劑轉染實驗也呈現出了相同的結果。
為了進一步驗證實驗結果,作者對小鼠模型靜脈注釋miR-223-3p 表達質粒和 KP1構建體內表達模型,結果顯示,miR-223-3p 的過表達加劇了 p16 、 γ-H2AX 、纖連蛋白、 I 型膠原和 α-SMA 的表達,所有這些都被 KP1 抑制,而miR-223-3p拮抗素的注射同樣消除了 UIRI 小鼠中的 p21、p16 和 γ-H2AX、纖連蛋白、膠原蛋白 I 和 α-SMA,恢復了腎功能。而 KP1、SB431542 (TβR1/2 抑制劑) 和 SIS3 (p-Smad3 抑制劑) 處理 TGF-β1 刺激的 HK-2 細胞結果進一步闡明了,KP1 通過阻斷 TGF-β1/Smad3/miR-223-3p 信號傳導來恢復 Klotho 表達并防止細胞衰老。
由于 miRNAs 和 lncRNAs 經常相互作用并相互調節,作者搜索了幾個 lncRNA-miRNA 相互作用數據庫,并預測 miR-223-3p 和 lncRNA-TUG1 (牛磺酸上調基因 1) 具有推定的結合位點,雙熒光素酶報告基因測定驗證了miR-223-3p 降低了野生型TUG1報告基因的熒光素酶活性,且在 HK-2 細胞中過表達 miR-223-3p 抑制了 lncRNA-TUG1,而KP1則消除了這個效果,TGF-β1抑制了HK-2細胞中lncRNA-TUG1的表達,而KP1、SB43154或SIS3則消除了此類效果,這些結果表明lncRNA-TUG1受TGF-β/Smad信號傳導的調節。而LncRNA-TUG1 沉默也降低了 Klotho 蛋白,但沒有降低其 mRNA 水平,說明miR-223-3p 可以與 lncRNA-TUG1 相互作用,形成競爭性內源性 RNA (ceRNA) 網絡,從而放大其在調節 Klotho 表達和細胞衰老中的作用。體內UUO和UIRI 模型中都驗證了這一點。
綜上所述,miR-223-3p 和 lncRNA-TUG1 協同工作,導致 Klotho 丟失、細胞衰老和腎纖維化,所有這些都被 KP1 緩解。KP1 是一種新發現的 Klotho 衍生肽,通過恢復 Klotho 表達來抑制細胞衰老,KP1 的這種作用由 miR-223-3p 和 lncRNA-TUG1 介導的轉錄后調節運作。通過恢復 Klotho 表達,KP1 充當 Klotho 誘導劑,并具有廣泛的腎保護特性,例如抗氧化、抗衰老和干細胞保護,有望將KP1轉化為 CKD 患者的臨床治療。
思路發散
本研究中利用miRNA測序、公共lncRNA數據庫以及公共轉錄組數據集共同分析出了miRNA與lncRNA共同構建ceRNA網絡在轉錄后水平調控蛋白表達的作用機制,對于較新的研究來說,可以直接通過全轉錄組,利用同一來源組織構建兩個文庫(lncRNA及小RNA文庫)得到包括lncRNA、miRNA、mRNA以及circRNA的結果,由此可分析出更可靠的相關性調控網絡,便于篩選關鍵非編碼RNA。
參考文獻:
[1] Chen LL, Kim VN. Small and long non-coding RNAs: Past, present, and future.Cell. 2024 Nov 14;187(23):6451-6485. doi: 10.1016/j.cell.2024.10.024. PMID:39547208.
[2] Zhang X, Li L, Tan H, Hong X, Yuan Q, Hou FF, Zhou L, Liu Y. Klotho-derived peptide 1 inhibits cellular senescence in the fibrotic kidney by restoring Klotho expression via posttranscriptional regulation. Theranostics. 2024 Jan 1;14(1):420-435. doi: 10.7150/thno.89105. PMID: 38164143; PMCID: PMC10750200.
]]>

期刊名稱:cell proliferation.
影響因子:5.9
合作單位:中國醫科大學盛京醫院
研究部位:大鼠胚胎
研究方法:空間轉錄組、免疫熒光、CCK-8、WB、ROS檢測等
百邁客生物為該研究提供了空間轉錄組測序服務。
研究背景
肛門直腸畸形 (ARM) 是兒童常見的先天性消化道畸形,發病率為 1/5000。ARM 的病因仍然難以捉摸,其發病機制與遺傳和環境因素有關。最近的研究強調了遺傳調控在這一過程中的關鍵作用。ARM 通常發生在妊娠 4-8 周,主要在出生后診斷,通常需要手術干預作為治療。然而,ARM 患者的長期術后結局并不理想,通常會導致并發癥,例如大便失禁和慢性便秘。這些并發癥對受影響兒童的生活質量和社會心理發展有重大影響。作者的空間轉錄組學分析確定了鐵死亡的發生,這是一種鐵依賴性的程序性細胞死亡,其特征是活性氧 (ROS) 和脂質過氧化產物在 ARM 后腸內積累。作者假設這個過程受活化 C 激酶受體 1 (Rack1) 的調節,細胞質蛋白與鳥嘌呤核苷酸結合蛋白有相似之處。它在細胞生長、分化、信號傳導和免疫反應中發揮著多種作用,并且在胚胎神經發育中具有潛在的意義。然而,以前的研究沒有報道 Rack1 在鐵死亡調節中的作用。因此,它在胚胎消化道發育和 ARM 形成中的作用需要進一步探索。
材料方法
使用Wistar 大鼠,在 ARM 組中,大鼠在 GD 10開始口服 1% ETU 125 mL/kg,對照組接受等劑量生理鹽水。從 GDs 14-16取胚胎。
1、空間轉錄組測序剖宮產后,立即將取出的胚胎置于冷生理鹽水中以去除表面血。將胚胎以水平矢狀方向放置在含有預冷OCT的包埋盒中儲存在 -80°C 冰箱中。共計6份樣品,切片包括尿道和后腸層。2、免疫熒光
選擇清晰全面顯示尿道、后腸、URS 和尿道回瘺的石蠟切片進行染色。
研究結果
1.空間轉錄組測序的注釋聚類
在這項研究中,作者在 GDs 14-16 (稱為 N14-16) 上使用正常的 Wistar 大鼠胚胎,在 GDs 14-16 (稱為 A14-16) 上使用 ETU 誘導的 ARM 胚胎進行空間轉錄組測序。制備大鼠胚胎的 6 個冷凍中矢狀切片,每個 10 μm 厚。這些切片包括尿道和后腸層,提供了特定時間點泄殖腔發育的全面視圖(圖 1A)。使用 10× Genomics Visium 空間轉錄組技術,然后進行組織透化、cDNA 合成和文庫構建,作者成功地捕獲了正常和 ARM 胚胎中的視覺基因轉錄數據,主要來自泄殖腔區域。為了確保來自同一區域的各種切片樣本之間的可比性和一致性,作者進行了聚類注釋,產生了七個不同的聚類。這些集群包括泄殖腔區域內的五個特定區域(集群 0-4),即尿道、后腸、膀胱、URS 和生殖器結節。此外,兩個簇 (簇 5 和 6) 對應于椎體和神經管區域 (圖 1A)。平均而言,每個解剖區域覆蓋 3005 個點,每個點捕獲 16,905 個基因(圖 1B)。

圖1-空間轉錄組測序的注釋聚類
2.正常組和 ARM 組之間的 DEG 篩選
鑒定 DEG 的標準被確定為絕對對數2 倍變化 (|log2FC|) ≥ 0.58 且顯著性水平為 p< 0.05. 這種篩選導致了差異火山圖的創建,以說明基因表達的改變。在 GDs 14、15 和 16 的后腸發育背景下,作者分別鑒定了 91、439 和 119 個基因,它們在這些時間點表現出不同的表達譜(圖 1C)。值得注意的是,Rack1 (Gnb2l1) 在 GDs 15 和 16 上在 ARM 組后腸內的表達降低。為了進一步探索潛在的分子相互作用,作者進行了全面的 PPI 分析。通過利用 BC 值作為排名標準,作者突出了最顯著的差異表達后腸基因(圖 1D)。樞紐基因,在環狀排列中用粉紅色節點表示,包括 Uba52、Rack1 和 Tpt1,在后腸發育的 GDs 15 和 16 期間,每個基因在基因網絡中都具有顯著的中心性。值得注意的是,Rack1 表現出卓越的連通性,在 GD 15 和 16 的 PPI 網絡中躋身前五名基因之列。
3.在 GD 15 上驗證后腸部分 DEGs
圖 2A-E 全面說明了 GD15 截面泄殖腔區域中前五個基因的蛋白質表達模式和定位:Rack1、Npm1、Eef1b2、Uba52?和?Tpt1。這些數字是使用免疫熒光染色獲得的。值得注意的是,這 5 種蛋白質在 N15 泄殖腔區域的尿道和后腸上皮內均表現出位點特異性表達。除?Tpt1?外,其他 4 種蛋白在 AM 區域內表現出表達水平升高。此外,觀察到這些蛋白質離散分布在 URS 的下肢和后腸的間質附近。相比之下,這五種蛋白的表達在 A15 泄殖腔區域的尿道和后腸上皮內明顯下降,伴隨著尿道直瘺部位的表達水平降低 (p < 0.05)。圖 2F 顯示了平均光密度 (AOD) 的半定量評估,特別是在后腸結構域內。

圖2-在 GD 15 上驗證后腸部分 DEGs
4.PROGENy 算法預測后腸中 MAPK 信號通路的集中富集
PROGENy 算法用于通過下游基因表達的變化評估信號通路的活性。作者獲得了正常組和 ARM 組 GDs 14-16 樣本中不同通路的活性水平評分。在使用 NNMF 對后腸區域(N14 因子 16、A14 因子 15、N15 因子 15、A15 因子 20、N16 因子 18 和 A16 因子 10)進行聚類分析中,PROGENy 算法顯示與 MAPK 信號通路呈強正相關,表明 MAPK 信號在后腸中顯著富集(圖 3A)。從這些區域提取來自 Erk、P38、JNK 和 Erk5 家族的 12 個成員分子的定位表達模式。具體來說,Mapk3 、 Mapk6 和 Mapk14 主要富集在泄殖腔區域。這些蛋白質的免疫熒光驗證證實了它們在尿道和后腸區域的特異性表達,在 URS 和間質區域的表達相對較弱,這與 PROGENy 預測一致(圖 3B)。

圖3-PROGENy 算法預測后腸中 MAPK 信號通路的集中富集用
5.通過細胞死亡基因定位探索 Gpx4 的時空表達模式
在基因集富集分析(GSEA)數據庫中,細胞死亡基因集包含161個基因,其中 7 個細胞死亡相關基因是從基因集與GD 15上簇1中的 DEGs 交集中獲得的(圖 4A)。圓形熱圖顯示了與聚類1的6個樣本相同區域內的細胞死亡基因的表達譜。值得注意的是,發現谷胱甘肽過氧化物酶家族的關鍵成員?Gpx4?在 GD 15 的簇 1 中下調(p < 0.05;圖 4B)。免疫熒光染色顯示 Gpx4 蛋白在尿道和后腸上皮以及 AM 區域的顯著定位,在 URS 中觀察到的分布相對較淺。在 ARM 組的泄殖腔中觀察到 Gpx4 陽性信號的減少(圖 4C)。AOD 分析表明,在 GDs 15 和 16 上,后腸中 Gpx4 表達在統計學上顯著降低(p < 0.05;圖 4D)。

圖4-通過細胞死亡基因定位探索 Gpx4 的時空表達模式
6.PD-L2 過表達抑制腫瘤細胞凋亡并促進對 EGFR-TKI 的耐藥
N15 胚胎石蠟切片的雙免疫熒光染色顯示 Rack1 和 Gpx4 蛋白在尿道和后腸上皮內共定位。該結果表明 Rack1 在調節這些組織中的鐵死亡中的潛在作用 (圖 4E)。隨后,進行顯微解剖以獲得正常和 ARM 胚胎的后腸組織。透射電子顯微鏡 (TEM) 顯示 ARM 組細胞線粒體體積減小,線粒體密度增加,線粒體嵴減少。這些觀察結果與與鐵死亡發生相關的線粒體形態變化一致(圖 4F)。
7.Rack1 在 GDs 14 和 16 上的時空表達譜
之前描述了 Rack1 蛋白在 GD 15 泄殖腔區的定位(圖 2A),作者進一步研究了它在 GDs 14 和 16 泄殖腔區的定位。在正常胚胎 (N14) 中,Rack1 陽性信號主要在尿道和后腸的上皮細胞中觀察到,后腸遠端的濃度較高。這些信號也分散在 URS 和間充質細胞內。在 ARM 胚胎 (A14) 中,在 URS 尖端、后腸和尿道上皮觀察到 Rack1 陽性細胞(圖 5A)。比較分析顯示,N14 和 A14 組之間 Rack1 陽性信號的 AOD 沒有顯著差異(圖 5B)。在 GD 16 (N16) 的正常大鼠胚胎中,Rack1 表達在尿道和后腸上皮中仍然突出,但在 URS 和周圍間充質區域受到限制(圖 5A)。值得注意的是,A16 后腸區域的熒光強度降低 (p < 0.05),如圖 5B 所示,這說明了后腸區域的半定量 AOD 結果。

圖5-Rack1 在 GDs 14 和 16 上的時空表達譜
8.敲低 Rack1 誘導腸上皮細胞鐵死亡
在 IEC-6 細胞中轉染 si-Rack1 后,使用 TEM 觀察細胞超微結構。si-Rack1 組表現出完整的細胞和核膜,線粒體大小減小,線粒體密度增加。此外,線粒體嵴減少或不存在,類似于 erastin 處理后觀察到的特征(圖 5C)。如 CCK-8 測定中觀察到的 Rack1 敲低導致細胞活力降低,LDH 測定所示,細胞毒性增加(p < 0.05;圖 5D)。使用 FerroOrange 探針的熒光分析表明 si-Rack1 組細胞內亞鐵離子濃度升高,在 Fer-1 處理后降低(p < 0.05;圖 5E)。使用 DCFH-DA 探針測量細胞內 ROS 水平顯示 si-Rack1 組的 ROS 水平較高,在 Fer-1 處理后下降(p < 0.05;圖 5F)。Liperfluo 探針評估揭示了 Fer-1 能夠減輕 si-Rack1 組中升高的脂質過氧化物水平 (p < 0.05;圖 5G)。熒光強度定量結果如右圖所示。
9.Rack1 敲低可增強 P38 磷酸化并調節下游 Nqo1/Gpx4 表達
如前所述,MAPK 信號通路在后腸區域顯著富集(圖 3A)。在 IEC-6 細胞中轉染 si-Rack1 后,使用 MAPK 信號通路 PCR 陣列在 mRNA 水平上鑒定受 Rack1 影響的下游分子。使用閾值 |log2FC|≥ 2 和 p < 0.05 用于 PCR 陣列差異基因篩選,作者觀察到 si-Rack1 組中 P38δ (Mapk13 encoding) 的統計學顯著升高(圖 6A、B)。Western blot 分析顯示,Rack1 敲低后磷酸化 P38 水平增加(圖 6C、D),表明對 Rack1 的干擾增強了 P38 磷酸化,從而激活了 IEC-6 細胞中的 P38-MAPK 信號通路。隨后,使用鐵死亡 PCR 陣列篩選 si-Rack1 和 doramapimod 處理組之間表現出 mRNA 水平變化的基因,揭示了總共 7 個基因(圖 6E)。此外,這 7 個基因的表達豐度數據與現有研究報告相結合,將 Nqo1 確定為下游分子,以供進一步研究。Western blotting 分析顯示,doramapimod 處理逆轉了 Rack1 敲除誘導的 Nqo1 蛋白水平降低(圖 6F)。此外,在 si-Rack1 組中觀察到的 Gpx4 降低被 doramapimod 抑制,并通過 2-HBA 處理恢復(圖 6G)。
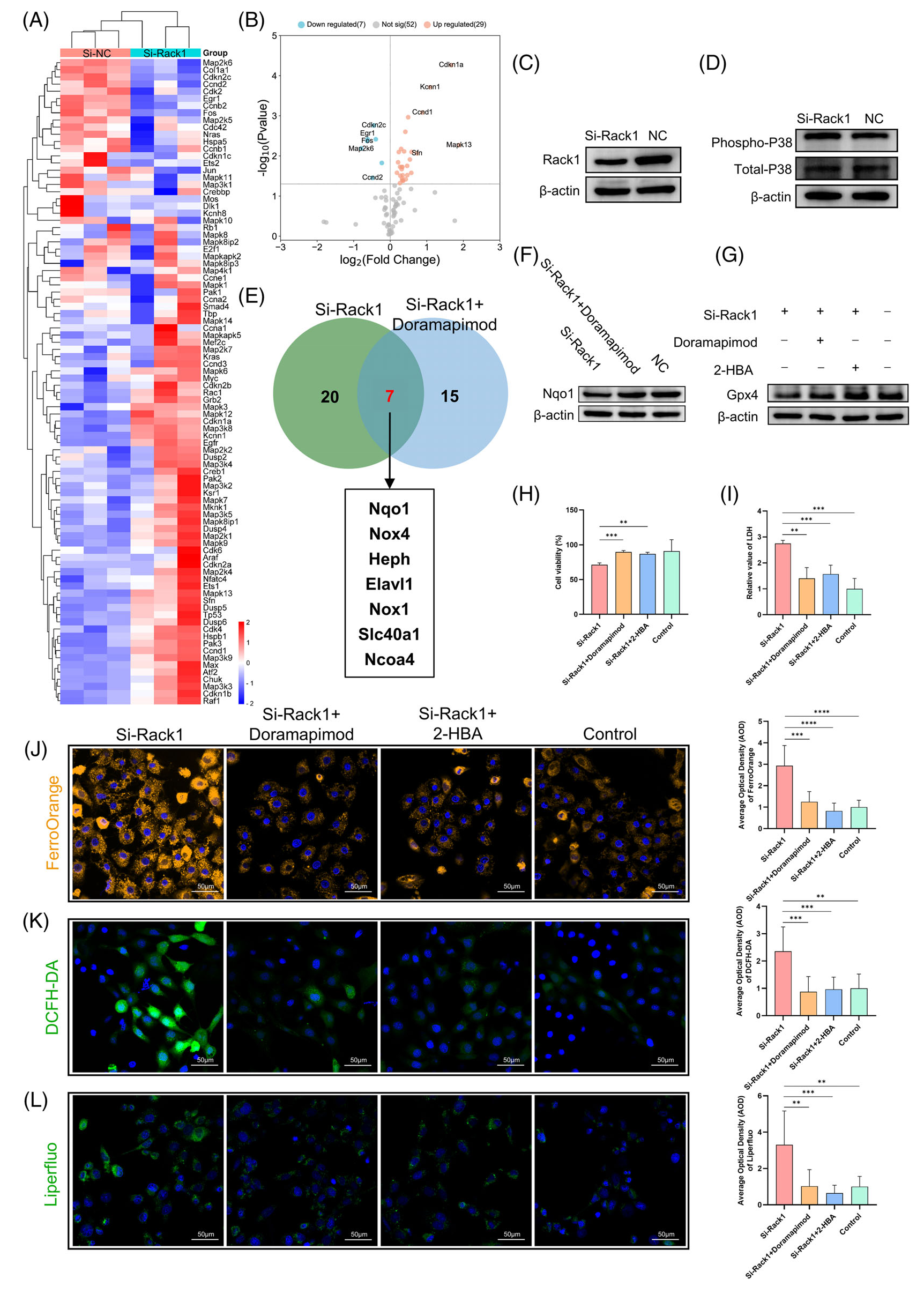
圖6-Rack1 敲低可增強 P38 磷酸化并調節下游 Nqo1/Gpx4 表達
10.Rack1?通過 P38 和 Nqo1 介導腸上皮細胞中的鐵死亡
在 IEC-6 細胞敲低 Rack1 的同時,使用 doramapimod 和 2-HBA 進行拯救實驗。結果顯示,與單獨的 Rack1 敲低相比,添加 doramapimod 和 2-HBA 導致細胞活力增加和相對 LDH 含量降低 (p < 0.05;圖 6H,I)。此外,在添加 doramapimod 和 2-HBA 后,細胞內亞鐵離子濃度降低,同時 ROS 和脂質過氧化水平降低(p < 0.05;圖 6J-L)。這些發現表明,Rack1 通過P38信號通路和 Nqo1 調節細胞內鐵含量和脂質過氧化,從而介導腸上皮細胞的鐵死亡。
研究總結
本研究利用空間轉錄組學技術對 GDs 14-16 期間的正常和 ARM 大鼠胚胎樣本進行測序。作者在后腸區域鑒定了具有高連接性的新樞紐基因,即?Rack1 、 Uba52 、 Tpt1 、 Npm1?和?Eef1b2。相比之下,作者觀察到 MAPK 信號通路的顯著富集和 Gpx4 在后腸區域的差異表達。值得注意的是,Rack1?在 GDs 15 和 16 的 ARM 后腸中表達降低,通過 P38/Nqo1/Gpx4 軸升高細胞內鐵、ROS 和脂質過氧化水平,最終誘導腸上皮細胞鐵死亡,并可能影響 ARM 后腸發育。這些發現增強了作者對 ARM 發病機制的理解,并對推進 ARM 產前診斷和治療策略的研究具有重要意義。
]]>